Sie sind hier: Startseite > Prostata > Operationen > Brachytherapie
Brachytherapie der Prostata: Technik und Nebenwirkungen
Indikationen zur Brachytherapie des Prostatakarzinoms
Die Brachytherapie des Prostatakarzinoms ist geeignet für die primäre Therapie des lokal begrenzten Prostatakarzinoms mit niedrigem und teilweise mit mittlerem Risiko. Die EAU-Leitlinie grenzt wie folgt ein: klinisches Stadium T1–2a, maximal 50% betroffene Stanzen mit Gleasonsumme 6 (ISUP Grad 1) oder maximal 33% betroffene Stanzen mit Gleason 3+4 (ISUP Grad 2), eine PSA-Konzentration unter 10 ng/ml, ein Prostatavolumen unter 50 ml und keine relevanten Miktionsbeschwerden (IPSS unter 12 und maximaler Uroflow über 15 ml/s). Die Beschränkung der Brachytherapie auf das Niedrigrisiko-Prostatakarzinom wird von zahlreichen Autoren angezweifelt, siehe Abschnitt Brachytherapie des Prostatakarzinoms.
Kontraindikationen
Prostatavolumen über 60 ml, Hochrisiko-Prostatakarzinom, obstruktive Miktionsbeschwerden, chronisch-entzündliche Darmerkrankungen, vorangegangene Beckenbestrahlung anderer Organe, deutlicher Resektionstrichter nach TURP.
Technik der Prostata-Brachytherapie
Reduktion des Prostatavolumens:
Bei zu großem Prostatavolumen (über 50 ml) kann durch eine mehrmonatige Antiandrogentherapie eine Volumenreduktion von 30–40 % erreicht werden.
Vorbereitung und Lagerung für die Seeds-Therapie:
Ein Einlauf am Abend vor dem Eingriff entleert das Rektum. Allgemeinanästhesie oder Spinalanästhesie. Steinschnittlagerung. Sterile Abdeckung der Beine und des Dammes nach Desinfektion. Zystoskopie und Anlage eines Dauerkatheters. Hochlagerung des Skrotums (Heftpflaster).
Vermessung der Prostata:
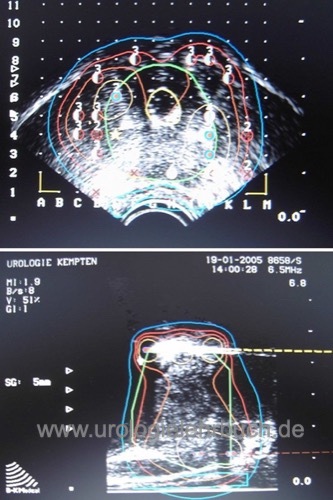
Der transrektale Schallkopf wird in das Rektum eingeführt und an einer beweglichen Schallkopfführung befestigt. An der Schallkopfführung ist eine Punktionshilfe mit einem Zielraster befestigt (engl. Template), welche die perinealen Punktionen erleichtert. Das Raster wird auf das Ultraschallbild projiziert. Der Schallkopf wird steril abgedeckt.
Die Prostata wird horizontal in 5 mm Schritten vom Harnblasenauslass bis zum Apex abgebildet. Die Bilder werden in das begleitende Computerprogramm importiert, die Prostatagrenzen, die Harnröhre und das Rektum werden markiert. Das Computerprogramm berechnet aus den horizontalen Schnittbildern das Prostatavolumen und erarbeitet einen Seeds-Implantationsplan (Dosimetrie) mit Isodosenlinien.
Das Zielvolumen beinhaltet meist einen Sicherheitsabstand von der Prostatakapsel von 3–8 mm, abhängig von den Tumordaten. Folgende Planungsvariablen werden vom Planungsprogramm berücksichtigt: V100 (Zielvolumen mit mindestens 100 % der Planungsdosis), urethrale und rektale V125 oder V150 (zu hohe Strahlenbelastung der Urethra oder des Rektums), V200 (zu hoch abgedeckte Areale des Zielvolumens). Die D100 ist ein weiterer wichtiger Parameter: die Dosis, welche 100% des Prostatavolumens abdeckt. Die Planungsdosis (auch Verschreibungsdosis genannt) bei 125Jod beträgt 145 Gy.
Implantation der Jod-Seeds:
Entsprechend dem Vorschlag des Computerprogramms werden die Jod-Seeds perineal implantiert. Die Verwendung von Seeds in Strängen (z. B. rapid strands) beschleunigt die Applikation und verhindert das Abwandern von einzelnen Seeds.
Die tatsächliche Lokalisation der Seeds nach der Implantation wird in der Computerapplikation eingegeben. Das Computerprogramm errechnet die weiteren Positionen der verbleibenden Seeds neu (intraoperative Dosimetrie)[Abb. Dosimetrie]. Eine Röntgenübersichtsaufnahme am Ende der Operation dokumentiert die Lage und die Anzahl der implantierten Seeds.
Nachplanung zur Qualitätskontrolle:
Innerhalb der ersten sechs Wochen nach Seedsimplantation wird ein Becken-CT veranlasst und die Lage der Seeds zur Dosisnachberechnung erfasst. Die D90 sollte über 140 Gy aufweisen, das bedeutet 90% des Prostatavolumens erhält eine Strahlendosis von mindestens 140 Gy. Bei einer relevanten Unterdosierung von Anteilen der Prostata ist prinzipiell eine Nachimplantation möglich.
Nachsorge der Brachytherapie beim Prostatakarzinom
Postoperativ wird der Dauerkatheter nach 1 Tag entfernt und der Restharn überprüft. Die prophylaktische Gabe von Alphablockern wie Tamsulosin oder Alfuzosin lindern die Miktionsbeschwerden nach Brachytherapie.
PSA-Bounce:
ein PSA-Anstieg nach Brachytherapie ist nicht zwingend ein Progress der Grunderkrankung, sondern kann durch die Strahlenwirkung auf das Prostatagewebe ausgelöst werden (engl. PSA-Bounce). Diese passagere PSA-Erhöhung tritt meist wenige Monate nach Seedsimplantation auf und kann bis zum Ende der Strahlenwirkung anhalten (bis zu 3 Jahre). Der PSA-Bounce tritt bei 44 % der Männer auf (Critz u.a., 2003).
Nebenwirkungen und Komplikationen der Brachytherapie
Die Nebenwirkungen und Komplikationen bei der Brachytherapie sind dosisabhängig. Eine fehlende intraoperative Dosimetrie oder perkutane Nachbestrahlung aufgrund unzureichender postoperativer Dosimetrie erhöhen die Nebenwirkungsrate (Sarosdy, 2004).
Obstruktive und irritative Miktionsbeschwerden:
Obstruktive Miktionsbeschwerden entstehen v. a. durch das Prostataödem nach der Seedsimplantation und sind meist nur passager. Eine längerfristige Obstruktion entstehen durch eine Harnblasenhalsstriktur oder Harnröhrenstriktur. Irritative Miktionsbeschwerden entstehen durch das Trauma, die radiogene Schädigung der Harnblase und der Harnröhre sowie durch die Obstruktion.
Klinisch manifestieren sich die Miktionsbeschwerden durch Dysurie, Restharnbildung, Pollakisurie, Harnverhalt, Makrohämaturie und Dranginkontinenz.
Therapeutisch sind Alphablocker Mittel der ersten Wahl, selten ist die Anlage eines suprapubischen Katheters notwendig.
TURP bei anhaltender Harnverhaltung:
Aufgrund des Verlusts der Strahlenwirkung und des Risikos für eine Inkontinenz wird eine zurückhaltende Indikation zur TURP nach Seedsimplantation empfohlen. Die spontane Heilung durch Abschwellen des Prostataödems und Prostataatrophie durch die Strahlenwirkung ermöglicht es in den allermeisten Fällen, bei Geduld des Patienten mit Hilfe eines suprapubischen DK auf eine TURP zu verzichten.
Rektale Nebenwirkungen:
Strahlenproktitis, rektale Blutungen. Rektumfisteln treten äußerst selten auf (unter 1 %), die therapeutischen Konsequenzen sind jedoch gravierend. Zumindest zeitweise sind eine Harnableitung und eine Kolostomie erforderlich.
Erektile Dysfunktion:
50 % der präoperativ potenten Männer erleben innerhalb von 3 Jahren nach Seedstherapie eine deutliche Verschlechterung der erektilen Funktion.
| Perineale Prostatektomie | suchen | Orchidopexie |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Critz u.a. 2003 CRITZ, F. A. ; WILLIAMS, W. H. ; LEVINSON, et a.: Prostate specific antigen bounce after simultaneous irradiation for prostate cancer: the relationship to patient age.In: J Urol
170 (2003), Nr. 5, S. 1864–7
Deger u.a. 2001 DEGER, S. ; BOHMER, D. ;
ROIGAS, et a.:
[Brachytherapy of local prostatic carcinoma].
In: Urologe A
40 (2001), Nr. 3, S. 181–4
Langley und Laing 2002 LANGLEY, S. E. ; LAING,
R.:
Prostate brachytherapy has come of age: a review of the technique and
results.
In: BJU Int
89 (2002), Nr. 3, S. 241–9
Nag u.a. 1999 NAG, S. ; BEYER, D. ;
FRIEDLAND, et a.:
American Brachytherapy Society (ABS) recommendations for
transperineal permanent brachytherapy of prostate cancer.
In: Int J Radiat Oncol Biol Phys
44 (1999), Nr. 4, S. 789–99
Sarosdy 2004 SAROSDY, M. F.:
Urinary and rectal complications of contemporary permanent
transperineal brachytherapy for prostate carcinoma with or without external
beam radiation therapy.
In: Cancer
101 (2004), Nr. 4, S. 754–60