Sie sind hier: Startseite > Hoden > Hodentumoren > Diagnose
Diagnose und Staging des Hodentumors (Keimzelltumoren)
- Hodentumor: Ursachen und Pathologie
- Hodentumor: Tumorstadien und Klinik
- Hodentumor: Diagnose
- Hodentumor: Therapie der Seminome
- Hodentumor: Therapie der Nichtseminome, Prognose
Früherkennung von Hodentumoren
Eine spezielle (ärztliche) Früherkennungsuntersuchung für Hodenkrebs wird nicht empfohlen. Gegen ein Screeningprogramm spricht die niedrige Inzidenz des Hodentumors und die guten Behandlungsergebnisse auch in fortgeschrittenen Tumorstadien. Der fehlende oder theoretisch geringe Nutzen einer Früherkennung wäre mit einer hohen Rate von falsch-positiven Ergebnissen, Ängste der Männer und Schäden durch diagnostische Testverfahren wie Hodenbiopsien verbunden. Die DGU empfiehlt eine monatliche Selbstuntersuchung der Männer zwischen 15–45 Jahren und fordert eine initiale Anleitung durch einen Urologen, dies wird aktuell von den Krankenkassen jedoch abgelehnt.
Obligate Diagnostik bei Verdacht auf einen Hodentumor
Tumormarker:
Die Hodentumormarker (außer LDH) sind aufgrund fehlender physiologischer Produktion beim Mann hochspezifisch und sensitiv. Eine Tumorlast von 105 Zellen kann nachgewiesen werden, lange vor dem Nachweis in der Bildgebung. Nur 10–15 % der fortgeschrittenen Keimzelltumoren haben normale Tumormarker.
Wichtig ist die Abnahme der Tumormarker vor der Orchiektomie. Bei erhöhten Markern sind weitere Bestimmungen alle 5–7 Tage nach Orchiektomie notwendig, um die Geschwindigkeit des Abfalls (Halbwertszeiten siehe unten) und den niedrigsten Wert (Nadir) zu ermitteln. Eine längere Halbwertszeit als normal spricht für eine metastatische Erkrankung, auch wenn das Nadir der Tumormarker den Normbereich erreicht. Die Höhe der Tumormarker nach Orchiektomie korreliert am besten mit der Prognose der Patienten, daher wurde das serologische Staging neu in die TNM-Klassifikation eingeführt. Für die Eingruppierung wird der niedrigste Wert (Nadir) der Tumormarker nach Orchiektomie verwendet.
Alpha-Fetoprotein (AFP):
Normwert <15 ng/ml bzw. <10 IU/ml. Halbwertszeit 5 Tage. Eine AFP-Erhöhung weist auf ein Nichtseminom hin, reife Teratome, reine Seminome oder reine Chorionkarzinome sind AFP-negativ.
Humanes Choriongonadotropin (HCG):
Normwert bei Männern <5 mIU/ml. Halbwertszeit 24–36 h. HCG wird bei Keimzelltumoren in chorionkarzinomatösen Anteilen oder von synzytiotrophoblastischen Riesenzellen (Seminom, embryonales Karzinom, Chorionkarzinom, Dysgerminom) gebildet. Werte über 500 mIU/ml sprechen gegen ein reines Seminom. Beim Chorionkarzinom korreliert die HCG-Konzentration fast linear mit der Tumormasse, wobei 10 mIU/ml ungefähr 1 000 000 Zellen entsprechen.
Laktatdehydrogenase (LDH):
Normwert 60–120 U/l. LDH ist ein ubiquitär vorkommendes intrazelluläres Enzym, nicht spezifisch für einen Hodentumor. LDH wird zur Beurteilung des Therapieerfolges und der Prognose von fortgeschrittenen Keimzelltumoren verwendet, da das Enzym sehr gut mit der Tumorlast korreliert.
Plazentare alkalische Phosphatase (PLAP):
wird teilweise von HCG-negativen Seminomen exprimiert, falsch-positiv bei Rauchern. Keine Standarddiagnostik.
M371-Test:
Quantitative PCR mit Nachweis von microRNA miR-371a-3p im Serum. Der Test zeigt eine deutliche höhere Sensitivität (90%) und Spezifität (94%) als alle anderen verfügbaren Marker, die microRNA wird von allen Keimzelltumoren außer Teratomen exprimiert (Dieckmann u.a., 2019). Der M371-Test ist keine Standarddiagnostik und kommerziell noch nicht verfügbar.
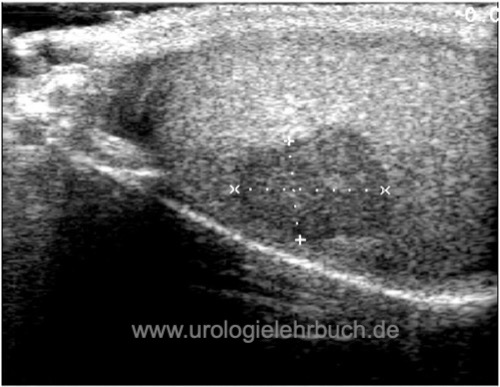
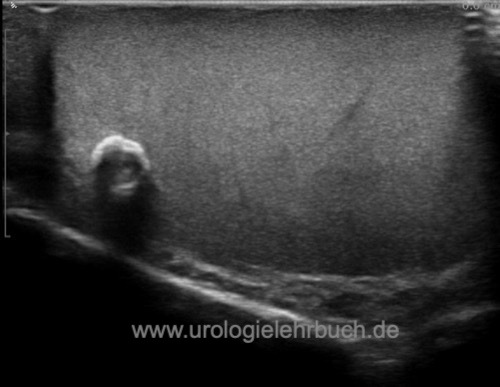
Diagnose eines Hodentumors durch Sonographie:
In der Sonographie der Hoden manifestiert sich ein Hodentumor typischerweise als echoarme bis echogemischte Läsion im Hodenparenchym mit verstärkter Durchblutung [Abb. Seminom im Ultraschall], [Abb. Teratom im Ultraschall] und [Abb. Embryonales Karzinom im Ultraschall].
 |
 |
 |
Obligat ist die Sonographie des kontralateralen Hodens zum Ausschluss eines bilateralen Hodentumors und zur Einschätzung des Risikos für eine GCNIS (Hodenvolumen? Testikuläre Mikrolithiasis (Sternenhimmel)?).
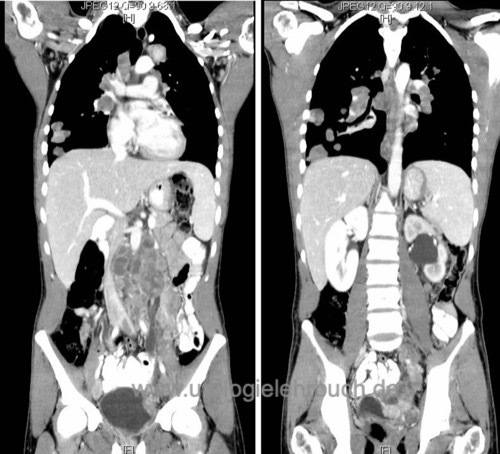
CT-Abdomen:
Das CT-Abdomen ist das Diagnostikum der Wahl zum Nachweis von retroperitonealen Lymphknotenmetastasen oder Lebermetastasen [Abb. Lymphknotenmetastasen in der CT]. Alternativ MRT-Abdomen bei Kontrastmittelallergie oder Kindern (siehe unten).
CT-Thorax:
Zum Nachweis von Lungenmetastasen oder mediastinalen Lymphknotenmetastasen. Das CT-Thorax wird zeitgleich mit dem CT-Abdomen durchgeführt.
Fertilitätsdiagnostik:
Patienten mit aktuellem oder in der Zukunft möglichen Kinderwunsch muss vor Orchiektomie die Möglichkeit der Kryokonservierung angeboten werden, zuvor sollte die Fertilität bestimmt werden: Spermiogramm, Testosteron, LH und FSH. Bei Patienten mit Azoospermie kann die (bilaterale) testikuläre Spermienextraktion während der Orchiektomie durchgeführt werden. Die Kosten für die vorsorgliche Erhaltung der Fertilität werden seit kurzem von den gesetzlichen Krankenkassen in Deutschland übernommen.
Fakultative Diagnostik
MRT-Hoden:
Ein MRT des Hodens ist indiziert zur weiteren Abklärung suspekter Befunde im Ultraschall, welche nicht unbedingt freigelegt werden müssen (seltene Indikation!).
Sonographie Abdomen:
Die Sonographie des Abdomens ist geeignet für eine schnelle Diagnose einer fortgeschrittenen Erkrankung [Abb. Retroperitoneale Metastase im US Abdomen]. Das CT-Abdomen ist sensitiver und kann durch die Sonographie nicht ersetzt werden.
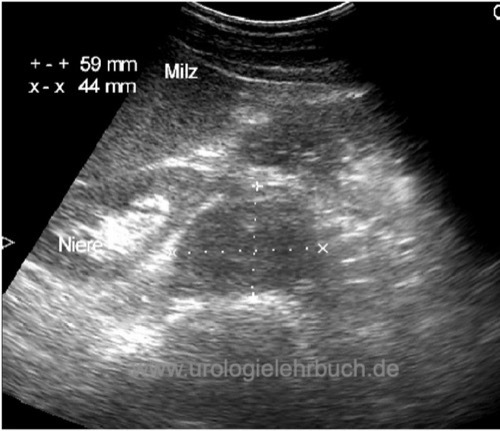 |
MRT-Abdomen
Das MRT besitzt eine vergleichbare diagnostischen Genauigkeit wie ein CT-Abdomen. Vorteile sind die fehlende Strahlenbelastung und das besser verträgliche Kontrastmittel. Nachteile sind eine längere Untersuchungsdauer, die fehlende gleichzeitige Bildgebung des Thorax und höhere Kosten. Die Leitlinien empfehlen nicht den routinemäßigen Einsatz der MRT in der primären Ausbreitungsdiagnostik. Anerkannte Indikationen für ein MRT sind Kinder und die Unverträglichkeit von jodhaltigem Kontrastmittel.
Kopf MRT oder CT:
Bei fortgeschrittener Erkrankung oder bei Symptomen verdächtig für Hirnmetastasen.
Knochenszintigraphie:
Bei klinischem Verdacht auf Knochenmetastasen.
PET:
Das PET hat für das primäre Staging bei nachgewiesenem Hodentumor vor Erstlinientherapie keine Bedeutung. Das Positronenemisionstomographie hat eine gesicherte Rolle bei der Diagnose von residualen Lymphknotenvergrößerungen nach primärer Therapie (Chemotherapie und/oder Strahlentherapie). Durch den Nachweis einer erhöhten Stoffwechselaktivität mit dem Tracer FDG kann zwischen Narbengewebe und Tumorgewebe unterschieden werden. Eine weitere Indikation zur PET besteht bei Anstieg der Hodentumormarker im Verlauf der Tumornachsorge.
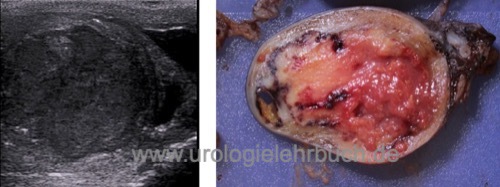
Inguinale Hodenfreilegung und Biopsie:
Bei kleinen Läsionen in der Sonographie oder MRT mit unklarer Dignität ist eine diagnostische inguinale Hodenfreilegung mit Tumorresektion eine Option, um die Orchiektomie zu vermeiden. Der Hodentumor wird per Schnellschnitt untersucht. Bei benignen Tumoren wird der Eingriff organerhaltend beeendet. Bei Nachweis eines malignen Hodentumors im Schnellschnitt ist die hohe inguinale Semikastration das Standardverfahren [Abb. Orchiektomiepräparat]. Bei kleinen malignen Läsionen kann nach einer kompletten Resektion des Tumors erwogen werden den Resthoden zu erhalten, insbesondere bei bilateraler Manifestation oder bei Einzelhoden. Da ein hohes Risiko für eine begleitende GCNIS besteht, soll eine adjuvante lokale Strahlentherapie des Hodens mit 16–20 Gy durchgeführt werden.
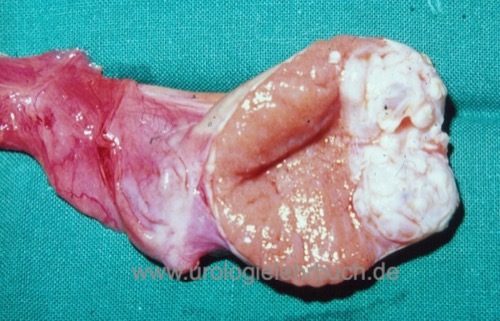 |
Kontralaterale Hodenbiopsie:
das Risiko einer kontralateralen GCNIS liegt zwischen 5–10 %. Risikofaktoren für eine kontralaterale GCNIS sind ein Hodenvolumen von unter 12 ml, Hodenhochstand in der Anamnese und einem Erkrankungsalter unter 30 Jahren, das Risiko beträgt dann 34 %. Die Optionen der kontralateralen Hodenbiopsie sollte zumindest bei Patienten mit Risikofaktoren für eine GCNIS diskutiert werden. Zur Technik der kontralateralen Hodenbiopsie siehe Abschnitt inguinale Orchiektomie.
Wenn eine cisplatinhaltige Chemotherapie schon zum Zeitpunkt der Orchiektomie absehbar ist, sollte keine kontralaterale Hodenbiopsie durchgeführt werden. Die Chemotherapie heilt die GCNIS in über 60 % der Fälle. Bei Risikofaktoren für eine GCNIS sollte die kontralaterale Hodenbiopsie ggf. zwei Jahre nach Abschluss der Therapie des Primärtumors durchgeführt werden.
Fertilitätsdiagnostik
Bei Patienten mit Kinderwunsch in der Zukunft sollte vor Orchiektomie die Fruchtbarkeit bestimmt werden: Spermiogramm, Testosteron, LH und FSH. Der Patient muss vor Orchiektomie über die Möglichkeit der Kryokonservierung informiert werden.
Bei Patienten mit bilateralen Tumoren, Einzelhoden, schwerer Oligozoospermie oder Aspermie ist die testikuläre Spermienextraktion während der Orchiektomie eine Option.
Differentialdiagnose
Siehe Abschnitt Skrotaler Tumor
| Hodentumor Pathologie und TNM | Suchen | Therapie von Seminomen |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Dieckmann, K.-P.; Radtke, A.; Geczi, L.; Matthies,
C.; Anheuser, P.; Eckardt, U.; Sommer, J.; Zengerling, F.; Trenti, E.;
Pichler, R.; Belz, H.; Zastrow, S.; Winter, A.; Melchior, S.; Hammel, J.;
Kranz, J.; Bolten, M.; Krege, S.; Haben, B.; Loidl, W.; Ruf, C. G.;
Heinzelbecker, J.; Heidenreich, A.; Cremers, J. F.; Oing, C.; Hermanns,
T.; Fankhauser, C. D.; Gillessen, S.; Reichegger, H.; Cathomas, R.;
Pichler, M.; Hentrich, M.; Eredics, K.; Lorch, A.; Wülfing, C.; Peine, S.;
Wosniok, W.; Bokemeyer, C. & Belge, G.
Serum Levels of
MicroRNA-371a-3p (M371 Test) as a New Biomarker of Testicular Germ Cell
Tumors: Results of a Prospective Multicentric Study.
Journal of
clinical oncology, 2019, JCO1801480
Albers, P.; Albrecht, W.; Algaba, F.; Bokemeyer,
C.; Cohn-Cedermark, G.; Fizazi, K.; Horwich, A.; Laguna, M.; Nicolai, N. &
Oldenburg, J.
EAU Guidelines: Testicular Cancer
. https://uroweb.org/guidelines/testicular-cancer/
DGU, DKG, AWMF, and L. Onkologie, “S3-Leitlinie Diagnostik, Therapie und Nachsorge der Keimzelltumoren des Hodens. Langversion 1.1.” [Online]. Available: https://www.leitlinienprogramm-onkologie.de/leitlinien/hodentumoren/
A. Stephenson, E. B. Bass, and B. R. Bixler, “Diagnosis and Treatment of Early-Stage Testicular Cancer: AUA Guideline.” [Online]. Available: https://www.auanet.org/guidelines-and-quality/guidelines/testicular-cancer-guideline
Kharazmi E., Hemminki K., Pukkala E., Sundquist K., Tryggvadottir L., Tretli S., Olsen J.H., and Fallah M. Cancer risk in relatives of testicular cancer patients by histology type and age at diagnosis: a joint study from five nordic countries, Eur Urol 2015, 68(2):283-89.
S. Krege, J. Beyer, R. Souchon, P. Albers, and EGCCCG-Members.
European consensus conference on diagnosis and treatment of germ cell
cancer: a report of the second meeting of the european germ cell cancer
consensus group (egcccg): part i.
Eur Urol, 53 (3): 478–496, Mar
2008a.
S. Krege, J. Beyer, R. Souchon, P. Albers, and EGCCCG-Members.
European consensus conference on diagnosis and treatment of germ cell
cancer: a report of the second meeting of the european germ cell cancer
consensus group (egcccg): part ii.
Eur Urol, 53 (3): 497–513, Mar
2008b.
Robert-Koch-Institut
Krebs in Deutschland 2017/2018
2021 https://www.krebsdaten.de/
W. Rodprasert, J. Toppari, and H. E. Virtanen, “Endocrine Disrupting Chemicals and Reproductive Health in Boys and Men.,” Front Endocrinol., vol. 12, p. 706532, 2021.
 English Version: Etiology, Pathology, tumor stages and diagnosis of germ cell tumors (testicular cancer)
English Version: Etiology, Pathology, tumor stages and diagnosis of germ cell tumors (testicular cancer)
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.