Sie sind hier: Startseite > Nieren > Nephrolithiasis > Ursachen, Symptome und Diagnose
Ursachen und Häufigkeit der Nephrolithiasis
- Nephrolithiasis: Ursachen der Steinentstehung
- Nierenkolik: Klinik und Diagnose
- Nierensteine: operative Therapie und Prophylaxe
Definition der Nephrolithiasis
Die Steinerkrankung der Nieren (Nephrolithiasis) führt zur Bildung von Konkrementen im Nierenbecken-Kelch-System, welche als Urolithiasis auch in die ableitenden Harnwege gelangen können (Harnleitersteine) (Moe u.a., 2006). Leitlinien der EAU: Urolithiasis. Davon abzutrennen sind Harnblasensteine, welche primär in der Harnblase entstehen.
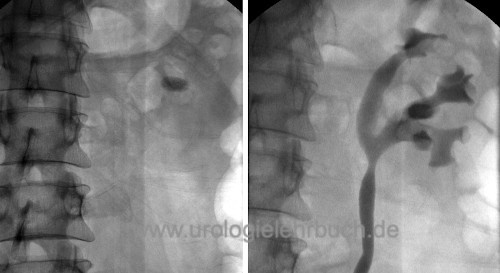 |
Häufigkeit (Epidemiologie)
Wohlstandserkrankung:
Häufung der Nephrolithiasis (Nierensteine) bei Erwachsenen in Gesellschaften mit Nahrungsüberfluss und bei reduzierter körperlicher Bewegung (starker Risikofaktor: metabolisches Syndrom). In diesen Gesellschaften ist jedoch das Risiko für eine Urolithiasis (Nierensteine) bei Kindern reduziert, Kinder entwickeln gehäuft Harnsteine in Gebieten mit Nahrungsmittelmangel.
Erkrankungsrisiko:
Die Inzidenz der Nephrolithiasis beträgt in Europa und USA etwa 0,5% (500/100000 Einwohner) pro Jahr. Das lebenslange Erkrankungsrisiko beträgt 10–15%. Steinpatienten haben ein Rezidivrisiko innerhalb von 10 Jahren von 50% (Moe u.a., 2006). Mehr als die Hälfte der Steinbildner hat nur ein Rezidiv, 10–20 % erleben 3 und mehr Rezidive im Verlauf ihres Lebens. Männer:Frauen = 4:1, familiäre Häufung.
Ursachen der Nephrolithiasis
Formale Pathogenese von Nierensteinen
Matrix:
ausgehend von einer organischen Matrix werden die Steinkristalle sekundär angelagert. Im reifen Stein hat die Matrix einen Anteil von 2–10 %.
Kristallisation:
Fünf Mechanismen führen zur Nierensteinentstehung:- Übersättigung
- Nukleation
- kristallines Wachstum
- Aggregation von Kristallen
- der Mangel an Inhibitoren der Nukleation, Kristallisation und Aggregation unterstützen die Nierensteinentstehung: Pyrophosphat, Citrat, Magnesium, Glykosaminoglykane, Heparin und Chondroitinsulfat.
Kalziumnephrolithiasis
Eine Hyperkalziurie wird variabel definiert: 5–7,5 mmol (200–250 mg) Kalzium /24 h Urin. Eine Hyperkalziurie wird bei 50 % der Nierensteinpatienten nachgewiesen. 80 % der Harnsteine sind kalzifiziert. 50 % des Blutkalziums (fast 100 % des ionisierten Kalziums) wird glomerulär filtriert, 95 % wird im proximalen und distalen Tubulus absorbiert und weniger als 2 % wird ausgeschieden.
Kalziumhaltige Nephrolithiasis:
kalziumhaltige Steine sind:
- Weddellit-Steine (Kalziumoxalatdihydrat)
- Whewellit-Steine (Kalziumoxalatmonohydrat)
- Hydroxyapatit-Steine (Kalziumphosphat)
- Brushit-Steine (Kalziumhydrogenphosphat)
Absorptive Hyperkalziurie:
von den 500–1000 mg Kalzium in der Nahrung werden normalerweise 150–200 mg im Dünndarm absorbiert, welche dann über den Urin wieder ausgeschieden werden. Bei erhöhter Kalziumabsorption im Dünndarm steigt die Kalziumkonzentration im Blut, welches zu einer verminderten Parathormonkonzentration führt. Der verminderte Parathormonspiegel führt zu einer verminderten tubulären Kalziumabsorption und damit zu einer Hyperkalziurie.
Resorptive (hormonelle) Hyperkalziurie:
ein primärer Hyperparathyreoidismus führt zu einer Hyperkalziämie durch gesteigerte Kalziumresorption aus dem Knochen und erhöhte Absorption aus dem Darm: es entsteht eine Hyperkalziurie, Nephrokalzinose und rezidivierender Nephrolithiasis.
Renale Hyperkalziurie:
Unklare tubuläre Defekte verursachen eine Hyperkalziurie und Hypokalziämie. Die Hypokalziämie führt zur vermehrten Freisetzung von Parathormon (sekundärer Hyperparathyreoidismus), erhöhten Synthese von Vitamin D3, Mobilisation von Kalzium aus dem Knochen und erhöhte Absorption aus dem Darm.
Monogenetische Ursachen für eine Hyperkalziurie:
Siehe Tab. Genetische Ursachen der Hyperkalziurie.
Hyperurikosurie:
Die Hyperurikosurie begünstigt nicht nur die Bildung von Harnsäuresteinen (s. u.), sondern auch von Kalzium-Nierensteinen. Die Hyperurikosurie reduziert die Wirkung von Inhibitoren der Lithogenese, typischerweise entstehen Kalziumoxalatsteine.
Hyperoxalurie:
erhöhte Oxalatausscheidung im Urin (>0,5 mmol/24 h Urin) führt zu Kalziumoxalatsteinen.
Sekundäre Hyperoxalurie:
Eine erhöhte enterale Resorption von Oxalat entsteht durch chronische Steatorrhö, wie bei Ileumerkrankungen, Pankreaserkrankungen usw. Die Fette im Darm verbrauchen bei Verseifungsprozessen das Kalzium im Darm, welches normalerweise das Oxalat bindet und die Resorption verhindert. Diätische Faktoren wie oxalatreiche Lebensmittel (Spinat, Rhabarber, Mangold) oder eine Vit. C-Substitution sind ebenfalls zu beachten.
Primäre Hyperoxalurie:
aufgrund von Enzymdefekten in der Leber entsteht ein massiver Anstieg der Oxalsäure, welche im Gewebe abgelagert wird. Die Oxalurie liegt typischerweise über 1 mmol/24 h Urin. Je nach Gendefekt kann die Erkrankung zur terminalen Niereninsuffizienz führen, neben der Harnsteinmetaphylaxe (s.u.) kann kausal nur die kombinierte Leber-Nieren-Transplantation helfen.
Hypozitraturie:
Zitrat ist ein Inhibitor der Lithogenese, durch Komplexbildung mit Kalzium und durch Behinderung der Kalziumsalzkristallisation. Eine Hypozitraturie wird bei 20–60 % der Kalziumsteinträger allein oder in Kombination mit anderen metabolischen Störungen als Ursache für die Steinbildung gefunden.
Die erniedrigte Ausscheidung von Zitrat entsteht i. d. R. durch eine erhöhte Säurebelastung des Körpers. Dies entsteht bei der distalen renalen tubulären Azidose (s. u.), Hypokaliämie, chronischer Diarrhoe, Hypomagnesiämie, Fasten, übermäßigem Fleischkonsum, Androgenabusus und übermäßigem körperlichen Training (Bodybuildersteine). Zitrat kann auch bei Harnwegsinfektionen durch die Bakterien verbraucht werden.
Säurestarre des Urins:
Die Säurestarre des Urins ist ein Risikofaktor für die Bildung von calciumhaltigen Nierensteinen. Es existieren mehrere Mechanismen für kontinuierlich saure Urin-pH-Werte unter 6. Die Säurestarre des Urins ist mit dem metabolischen Syndrom, der Insulinresistenz bei Diabetes mellitus Typ 2 und einer hohen Zufuhr an tierischen Proteinen assoziiert.
Renale tubuläre Azidose (RTA):
die renale tubuläre Azidose ist eine Erkrankungsgruppe mit tubulären Störungen der Protonenausscheidung oder Bikarbonatresorption mit Ausbildung einer metabolischen Azidose.
Typ 1 (distale) RTA:
gestörte Protonensekretion des distalen Nephrons (Defekt der Typ-A-Zwischenzellen der Sammelrohre) mit Ausbildung einer hypokalämischen, hyperchlorämischen metabolischen Azidose, Nephrolithiasis, Nephrokalzinose und erhöhtem Urin-pH. Die Ausprägung der Erkrankung ist je nach Vererbung und Enzymdefekt variabel. Typischerweise zeigen sich im Tagesprofil des Urin-pH immer Werte über 5,8 und es entstehen Kalziumphosphatsteine. Auch nach Säurebelastung (Ammonium-Chlorid 0,1 g/kgKG) bleibt der Urin-pH über 5,4. Je nach Ausprägung der metabolischen Azidose wird zwischen einer inkompletten (normale Bikarbonatkonzentration in der BGA) oder kompletten (erniedrigte Bikarbonatkonzentration) renalen tubulären Azidose unterschieden.
Typ 2 (proximale) RTA:
Defekt der Bikarbonatresorption im proximalem Tubulus mit Wachstumsverzögerung der Kinder, Hypokaliämie, metabolische Azidose und rachitische Veränderungen. Durch die normale Zitratausscheidung entsteht typischerweise keine Nephrolithiasis.
Typ 4 (distale) RTA:
meist bedingt durch eine chronische Nierenschädigung (Diabetes mellitus...) entsteht eine unzureichende Natriumreabsorption, dadurch werden Protonen und Kalium unzureichend ausgeschieden. Zusätzlich besteht eine Aldosteronresistenz. Eine Nephrolithiasis ist nicht typisch.
Weitere Nierensteinarten
Infektsteine:
10 % aller Nierensteine. Bestehen aus Magnesium, Ammonium und Phosphat (MAP, Struvit), sie können aber auch Anteile von Calciumphosphat enthalten. Ursächlich sind Harnwegsinfektionen mit Harnstoff-spaltenden Bakterien, welche das Enzym Urease besitzen. Die resultierende Ammoniumproduktion bewirkt einen alkalischen Urin (i. d. R. >7), dann können MAP-Kristalle präzipitieren. Die häufigsten Urease-produzierenden Bakterien bei Harnwegsinfektionen sind Proteus, Klebsiella, Pseudomonas und Staphylokokken.
Harnsäuresteine:
10 % aller Harnsteine. Harnsäuresteine sind röntgennegativ (nicht sichtbar im konventionellen Röntgen-Abdomen), erzeugen aber den typischen Steinschatten im Sonogramm und sind in der Computertomographie sichtbar. Harnsäuresteine entstehen bei Hyperurikosurie und bei einem sauren Urin-pH, niedrige Diuresemengen sind ebenfalls ein Risikofaktor. Zahlreiche Erkrankungen bewirken o.g. Risikofaktoren, der wichtigste pathophysiologische Faktor ist der saure Urin-pH.
Hyperurikosurie:
definiert als die tägliche Harnsäureausscheidung über 4 mmol/24 h Urin, eine Hyperurikämie muss nicht obligat vorhanden sein. Vermehrte Purinzufuhr mit der Nahrung, endogene Überproduktion durch Enzymdefekte, myeloproliferative Erkrankungen, Tumorzerfall, Chemotherapie, Medikamente (Probenicid) oder katabolische Zustände sind ursächlich für die Hyperurikosurie.
Zystinsteine:
1–2 % aller Harnsteine. Heterozygote (1:200) und homozygote (1:20 000) Manifestation der Zystinurie führt bei saurem pH zu einer Präzipitation der Zystinsteine. Im Röntgen ist der abgerundete milchglasartige Stein typisch. Zystinsteine sind für eine Therapie mit der ESWL ungeeignet.
Xanthinsteine:
entstehen bei dem angeborenen Defekt der Xanthinoxidase und sind wie Harnsäuresteine nicht röntgendicht.
2,8-Dihydroxyadeninsteine:
Kinder mit angeborenen Defekten der Adenin-Phosphoribosyltransferase (APRT) bilden 2,8-Dihydroxyadeninsteine.
Indinavir-Steine:
entstehen durch eine Medikation mit dem HIV-Virostatikum Indinavir. Die Steine sind nicht röntgendicht und werden auch in der CT nicht zuverlässig erkannt.
| Nierentransplantation | Suchen | Nierensteine |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Coe u.a. 2005 COE, F. L. ; EVAN, A. ;
WORCESTER, E.:
Kidney stone disease.
In: J Clin Invest
115 (2005), Nr. 10, S. 2598–608
Leitlinien der EAU: Urolithiasis
Moe 2006 MOE, O. W.:
Kidney stones: pathophysiology and medical management.
In: Lancet
367 (2006), Nr. 9507, S. 333–44
 English Version: Epidemiology and etiology of nephrolithiasis
English Version: Epidemiology and etiology of nephrolithiasis
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.