Sie sind hier: Startseite > Prostata > Operationen > Prostatektomie > Retropubische Prostatektomie
Retropubische radikale Prostatektomie: Technik und Komplikationen
Indikationen der retropubischen radikalen Prostatektomie
Die radikale Prostatektomie (RPE) ist bei Patienten mit lokalisiertem Prostatakarzinom und einer Lebenserwartung von mindestens 10 Jahren der Goldstandard der kurativen Therapie (Graefen u.a., 2006). Ausführliche Darstellung der Therapieoptionen siehe Kapitel Prostatakarzinom.
Kontraindikationen
Absolute Kontraindikationen sind unkorrigierte Gerinnungsstörungen und unbehandelte Harnwegsinfektionen. Weitere Kontraindikationen sind abhängig von den Grunderkrankungen (Operationsrisiko) und der Bedeutung der Prostatektomie für die Lebenserwartung des Patienten.
Präoperative Vorbereitungen für die radikale Prostatektomie
Operationszeitpunkt:
Eine nervenerhaltende Prostatektomie sollte frühestens 8 Wochen nach Prostatabiopsie und 3 Monate nach TURP durchgeführt werden. Dadurch werden Verwachsungen der Prostata mit der Umgebung und dem Gefäßnervenbündel reduziert.
Eigenblutspende:
Es besteht keine Kontraindikation aus onkologischer Sicht, aufgrund des geringen Transfusionsrisikos wird eine Eigenblutspende jedoch nicht empfohlen.
Darmvorbereitung:
Die Darmvorbereitung besteht aus klare Brühe und Trinken am Vortag, Abführen (Klistier) am Abend vor der OP.
Lagerung zur retropubischen radikalen Prostatektomie:
Rückenlage mit leichter Lumbarextension und leicht gespreizten Beinen. Nach Desinfektionund steriler Abdeckung wird ein Dauerkatheter 16 CH und 30 ml Blockung in die Harnblase eingelegt.
Anästhesie der radikalen Prostatektomie:
In der Regel Allgemeinanästhesie. Die Spinalanästhesie ist möglich, wenn auf eine Lymphadenektomie verzichtet wird.
Antibiotikaprophylaxe:
Perioperative Antibiotikaprophylaxe vor dem Hautschnitt z. B. Cephalosporin der 2. Generation.
Technik der retropubischen radikalen Prostatektomie
Extraperitonealer Zugang:
Medianer Unterbauchschnitt von Nabel bis Symphyse. Durchtrennung des vorderen Blattes der Rektusscheide und der Fascia transversalis. Stumpfe Erweiterung des Spatium retropubicum, dabei wird das Peritoneum nach kranial abgeschoben. Darstellung der Vasa iliaca ext. und int., Harnleiter und Vasa testicularis. Einsetzen eines Retraktorsystems.
Pelvine Lymphadenektomie beidseits:
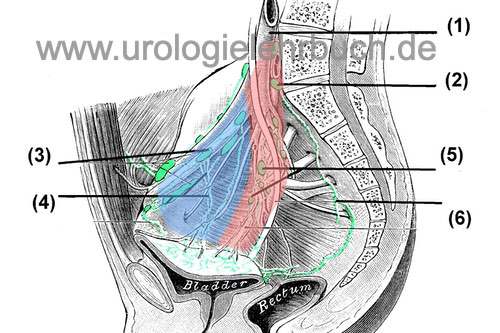
Bei Patienten mit niedrigen Risiko (PSA <10 ng/ml und Gleason <7) kann auf eine Lymphadenektomie verzichtet werden, ansonsten gilt die Staging-Lymphadenektomie im Rahmen der Prostatektomie als Standard. Dissektionsgrenzen sind lateral die A. iliaca externa, kaudal der Ramus superior des Os pubis, medial das Lig. umbilicale und die Harnblase, in der Tiefe der N. obturatorius und die Beckenwand, kranial der Ureter und die Gabelung der A. iliaca communis [Abb. pelvine Lymphadenektomie]. Bei der ausgedehnten Lymphadenektomie wird die Dissektion bis zur Aorta, im Bereich der A. iliaca interna und präsakral ausgedehnt. Es ist bisher nicht nachgewiesen, dass eine ausgedehnte Lymphadenektomie einen Überlebensvorteil bewirkt, sie wird jedoch bei Hochrisikopatienten von der S3-Leitlinie empfohlen. Eine sorgfältige Präparationstechnik mit bipolarer Koagulation, Applikation von Clips oder dünnen Ligaturen senkt die Komplikationsrate durch Lymphozelen.
 |
Freilegung der Prostata:
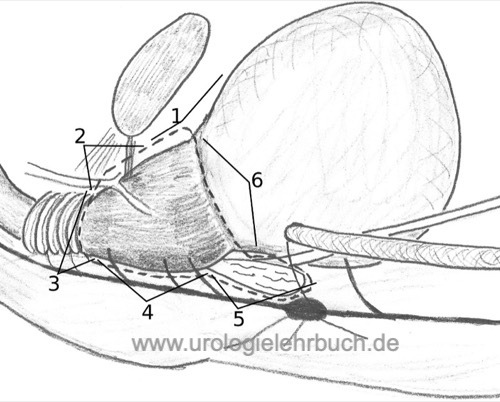
Die Prostata wird mit dem Retraktionssystem nach kranial luxiert, von Fettgewebe befreit und dabei störende oberflächliche Venen koaguliert und durchtrennt [Abb. RRP Schema (1)]. Beidseitige Inzision der endopelvinen Faszie bis zum Ligamentum puboprostaticum, dieses wird beidseits nahe am Ramus inferior des Os pubis durchtrennt. Nun kann der Apexbereich der Prostata mit einem Präpariertupfer stumpf freigelegt werden.
Durchtrennung des Venenplexus Santorini:
Mit einer Babcock-Klemme wird der Venenplexus über dem Apex der Prostata gefasst und mit einer Durchstechungsligatur versorgt. Analoges Vorgehen für den Venenplexus auf der Prostata gegen die Rückblutung. Der Venenplexus wird schrittweise bis auf die Urethra durchtrennt, blutende Gefäße werden bipolar koaguliert oder übernäht. Die Präparation muss flach die Schicht zwischen Venenplexus und Prostata finden, es besteht die Gefahr der R1-Resektion bei Tumoren im anterioren fibromuskulären Stroma [Abb. RRP Schema (2)].
Nervenschonung während der radikalen Prostatektomie:
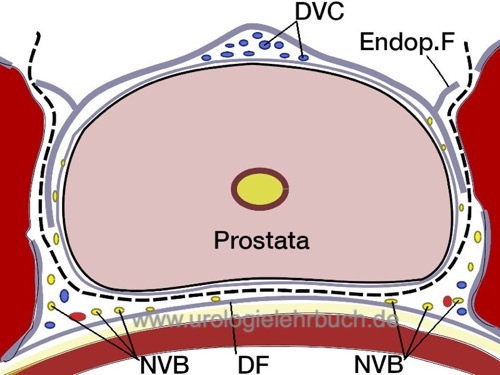
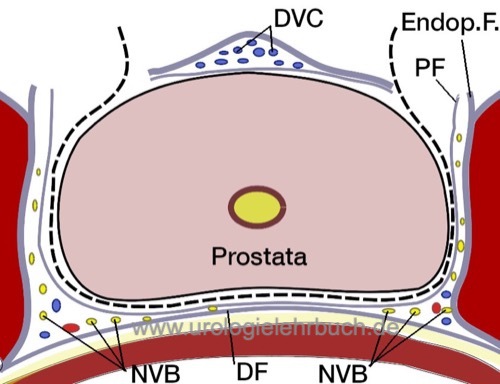
Für eine nervenschonende Prostatektomie wird die der Prostata aufliegenden Faszie basal beginnend durchtrennt, um das Nervenbündel nach lateral zu isolieren. Mit dem Overholt wird diese Präparationsschicht zum Apex verfolgt, vor Durchtrennung der Faszie werden Clips zur Blutstillung verwendet. Nachdem das Nervenbündel nach lateral separiert wurde, kann die Harnröhre ohne Gefahr der apikalen Nervenverletzung durchtrennt werden. In Abhängigkeit von Patientenwunsch und Tumorstadium kann mit unterschiedlichem Ausmaß die Nervenschonung durchgeführt werden, siehe Abb. Anatomie der Nervenschonung bei radikaler Prostatektomie. Die intrafaszielle Technik führt zu einer besseren Schonung der Erektionsfähigkeit, das zusätzliche Risiko für eine R1-Resektion ist jedoch umstritten.
Durchtrennung der Harnröhre:
Durchtrennung des ventralen Anteils der Harnröhre, bis der Katheter gut sichtbar ist [Abb. RRP Schema (3)]. Bei 9, 11, 1 und 3 Uhr werden Anastomosennähte vorgelegt (doppelt armierter Faden wie z. B. PDS 2–0 oder Vicryl 2–0 mit 5/8-Nadel).
Nach dem Abklemmen des Harnblasenkatheters in der eröffneten Harnröhre wird das Ventilstück abgetrennt und der Katheter ins Becken gezogen. Er dient bei erhaltener Blockung als Präparationshilfe für die Prostata. Durchtrennung der dorsalen Urethra und der dorsalen Anteile des externen Sphinkters, welche am Apex der Prostata ansetzen. Danach werden zwei Anastomosennähte bei 5 und 7 Uhr vorgelegt. Zusätzliche Nähte können durch den dorsalen Sphinkterapparat vorgelegt werden, welche später den Harnblasenhals fassen (Rocco-Nähte). Dies soll zu einer Verbesserung der Frühkontinenz und Dichtigkeit der Anastomose führen (Rocco u.a., 2009).
Aszendierende Prostatektomie:
Die Schicht zwischen Rektum und Prostata wird nach Durchtrennung von Resten des M. sphinkter externus dargestellt. Die Schicht zwischen Prostata und Rektum wird stumpf (mit dem Finger oder einem Präpariertupfer) nach basal verfolgt. Das Gefäßnervenbündel wird mit dem Overholt von der Prostata separiert, Gefäße zur Prostata werden zwischen Clips durchtrennt [Abb. RRP Schema (4)]. Die Prostata wird durch Zug an dem Katheter nach oben geklappt, die Prostatapedikel werden dadurch angespannt und zwischen Clips schrittweise durchtrennt.
Präparation der Samenblasen:
Die aszendierende Präparation legt die Samenblasen frei, welche unter der Denonvillier-Faszie sichtbar werden. Nach Inzision der Denonvillier-Faszie werden die Samenblasen mobilisiert und versorgende Gefäße zwischen Clips durchtrennt Es ist wichtig, eng an der Samenblase zu bleiben, da sonst das Nervenbündel lateral an der Spitze der Samenblasen verletzt werden kann [Abb. RRP Schema (5)]. Beide Samenleiter werden medial der Samenblasen isoliert und nach Versorgung mit Clips durchtrennt. Nach zirkulärer Mobilisation der Samenblasen werden an den Samenblasenspitzen die Gefäßversorgung geclippt und durchtrennt. Die Samenblasen werden nun zur Prostata "hochgeklappt" und der Harnblasenhals präpariert, eine gebogene Schere (Satinsky) erleichtert die Präparation.
Deszendierende Prostatektomie:
Die deszendierende Präparation kann jederzeit die aszendierende Präparation bei unübersichtlicher Anatomie ablösen, manche Autoren propagieren auch primär die deszendierende Präparation. Vor der primär deszendierenden Präparation wird das Gefäßnervenbündel durch Inzision der Prostatafaszie analog zur aszendierenden Präparation isoliert.
Harnblasenhalspräparation:
Je nach Tumorstadium wird der Harnblasenhals geschont oder reseziert. Durch Zug am Katheter erscheint deutlich die Grenze zwischen Harnblase und Prostata, dort wird die Harnblasenmuskulatur von der Prostata (mit oder ohne Sicherheitsabstrand) abpräpariert [Abb. RRP Schema (6)]. Blutungen werden bipolar koaguliert. Die zirkulären Muskelfasern des Harnblasenhalses helfen die richtige Schicht bei der Erhaltung des Harnblasenhalses zu finden.
Rekonstruktion des Harnblasenhalses:
Eine Rekonstruktion des Harnblasenhalses ist bei sorgfältiger Schonung bei der Resektion nicht notwendig. Bei zu weitem Harnblasenhals wird dieser durch Nähte bei 6 Uhr eingeengt ("tennis racket"-Naht) und die Schleimhaut durch dünne Nähte evertiert. Cave Harnleiter und Ostien.
Harnröhrenanastomose:
Einlage eines 20 CH Harnröhrenkatheters in die Harnblase. Die an der Harnröhre vorgelegten Anastomosennähte werden an korrespondierender Stelle durch den Harnblasenhals geführt. Die Anastomosenfäden werden von dorsal nach ventral geknotet. Die Harnblase wird über den Katheter gespült, um Koagel zu entfernen und die Dichtigkeit zu prüfen.
Wundverschluss:
Robinson-Drainage 20 CH in das kleine Becken. Spülung mit NaCl und letzte Kontrolle der Hämostasis. Fortlaufender Verschluss des vorderen Blattes der Rektusscheide mit kräftiger Naht (USP 1). Subkutannaht. Hautnaht.
Nachsorge der radikalen Prostatektomie
Allgemeine Maßnahmen:
Frühe Mobilisation. Thromboseprophylaxe: Heparin-Injektionen oberhalb des Nabels für insgesamt vier Wochen. Laborkontrollen (Hb). Wundkontrollen. Tumornachsorge.
Analgesie:
Schmerztherapie mit einer Kombination aus Nichtopioid-Analgetika und Opioid-Analgetika.
Kostaufbau:
Erster postoperativer Tag Tee, Suppe und Weißbrot. Leichte fettarme Kost die folgenden Tage bis zum Stuhlgang. Macrogol zur Stuhlerweichung.
Drainagen und Katheter:
Drainagen bis sie aufhören zu fördern (<30 ml/24 h). Katheterentfernung nach 7–14 Tagen (je nach Ausmaß der Harnblasenhalsresektion), vorher Prüfung der Dichtigkeit mit einem Zystogramm.
Onkologische Ergebnisse der radikalen Prostatektomie
Siehe Kapitel Prostatakarzinom.
Komplikationen der retropubischen radikalen Prostatektomie
Blutung:
Die Blutungsmenge beträgt um 700 ml, die Transfusionsrate liegt unter 5%.
Lymphozelen:
Je ausführlicher die Lymphadenektomie, desto häufiger entstehen Lymphozelen [Abb. Lymphozele nach Prostatektomie]. Vermeidung durch sorgfältige Ligatur der Lymphgefäße, limitierte Lymphadenektomie, Aussparung der Lymphgefässe der unteren Extremität entlang der A. iliaca ext., Injektion von Heparin in die obere Extremität. Die Therapie besteht in der perkutanen Drainage oder laparoskopischen Fensterung.
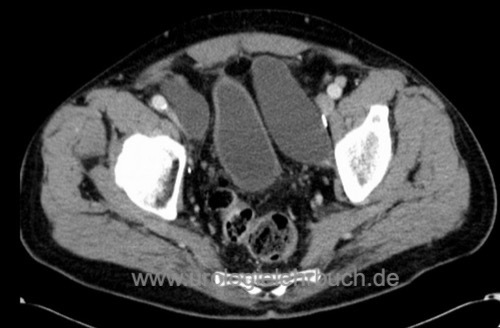 |
Rektumverletzung:
Rektumverletzungen sind selten und werden zweischichtig intraoperativ versorgt. Wenn möglich wird die Übernähung mit Omentum majus bedeckt. Bei Insuffizienz der Übernähung ist die Anlage eines passageren Anus praeter notwendig. Risikofaktoren für eine Rektumverletzung sind das fortgeschrittene Tumorstadium, Voroperationen oder Radiatio der Prostata. Eine Rektumverletzung oder Wundheilungsstörung kann auch eine Rektum-Harnröhrenfistel verursachen [Abb. Rektumfistel nach Prostatektomie]. Klinische Hinweise sind Pneumaturie und flockiger Urin. Eine Fäkalinkontinenz ist selten möglich.
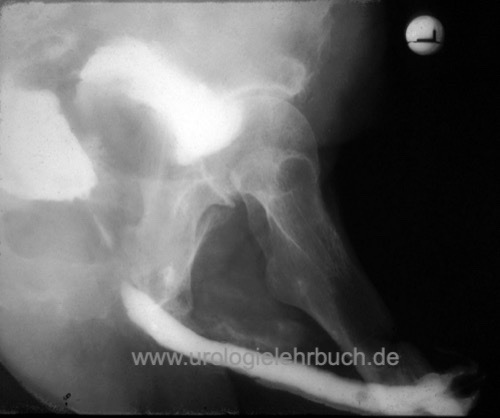 |
Harninkontinenz:
Häufig ensteht nach der Operation eine Belastungsinkontinenz, für 1–2 Jahre kann eine spontane Besserung der Harninkontinenz erwartet werden. Im Langzeitverlauf werden ungefähr 10 % der Patienten mehr als eine Vorlage benötigen. Die Beckenbodengymnastik (mit oder ohne Biofeedback) hilft in der Verbesserung der Frühkontinenz, der Effekt auf die Spätkontinenz ist weniger deutlich (MacDonald u.a., 2007). Risikofaktoren für eine postoperative Inkontinenz sind: Alter über 70 Jahre, fortgeschrittenes Tumorstadium, vorangegangene TURP. Zur Therapie der Harninkontinenz siehe Abschnitt männliche Stressinkontinenz.
Erektile Dysfunktion:
Die Prostatektomie führt zur einer deutlichen Verschlechterung der erektilen Funktion. In kontrollierten Studien sind langfristige Potenzraten von nur 30 % bei beidseitiger Nervenerhaltung beschrieben worden. Die Therapie mit oralen Phosphodiesterasehemmer ermöglicht zusätzlich bei 20 % der Patienten den Geschlechtsverkehr (insgesamt 50 %). Die langfristige postoperative Potenz kann durch eine frühzeitige Gabe von oralen Phosphodiesterasenhemmern verbessert werden. Ob die frühzeitige Gabe dauerhaft oder nach Bedarf gegeben werden sollte, ist umstritten [Montorsi 2008]. Prädiktoren für eine postoperative Potenz sind beidseitiger Nervenerhalt, sexualaktiver junger Patient mit guter präoperativer Potenz, PSA <10 ng/ml, Gleason <8 (geringe Tumorlast).
Leistenhernie:
Das Risiko für eine Leistenhernie beträgt ungefähr 13–19% nach RRP versus 3% in Kontrollgruppen ohne OP, die Leistenhernie entsteht meist in den ersten zwei Jahren (Zhu u.a., 2012). Die prospektiv-kontrollierte LAPPRO-Studie fand keine relevanten Unterschiede (7,3–8,4% Hernienrisiko) nach offen-chirurgischer oder roboter-assistierter laparoskopischer Technik (Nilsson u.a., 2022).
Weitere Komplikationen:
Wundinfektionen, Anastomosenstriktur, Anastomoseninsuffizienz, Harnleiterverletzung, Penisverkürzung, Ileus. Kardiovaskuläre Komplikationen: Thrombose, Lungenembolie, Herzinfarkt. Mortalität 0,4 %, Hauptursache Lungenembolie.
 |
Prostatektomie in Augsburg
Sie wünschen die Prostatektomie in Augsburg beim Autor dieser Seite? Vereinbaren Sie einen Termin bei Dr. Manski in der Urologischen Gemeinschaftspraxis, Gögginger Str. 49 in Augsburg unter der Telefonnummer 0821 512200. Weitere Informationen zu Dr. Manski siehe Urologische Gemeinschaftspraxis Augsburg.
| Retropub. Adenomektomie | Suchen | lap. pelvine Lymphadenektomie |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
P. Dell’Oglio, A. Mottrie, and E. Mazzone, “Robot-assisted radical prostatectomy vs. open radical prostatectomy: latest evidences on perioperative, functional and oncological outcomes.,” Current opinion in urology, vol. 30, no. 1, pp. 73–78, 2020, doi: 10.1097/MOU.0000000000000688.
Graefen u.a. 2006 GRAEFEN, M. ; WALZ, J. ;
HULAND, H.:
Open retropubic nerve-sparing radical prostatectomy.
In: Eur Urol
49 (2006), Nr. 1, S. 38–48
Montorsi, F.; Brock, G.; Lee, J.; Shapiro, J.; Poppel,
H. V.; Graefen, M. & Stief, C.
Effect of nightly versus on-demand
vardenafil on recovery of erectile function in men following bilateral
nerve-sparing radical prostatectomy.
Eur Urol, 2008,
54, 924-931.
H. Nilsson et al., “Risk of hernia formation after radical prostatectomy: a comparison between open and robot-assisted laparoscopic radical prostatectomy within the prospectively controlled LAPPRO trial.,” Hernia, vol. 26, no. 1, pp. 157–164, 2022, doi: 10.1007/s10029-020-02178-7.
Rocco, F. & Rocco, B.
Anatomical reconstruction
of the rhabdosphincter after radical prostatectomy.
BJU Int, 2009,
104, 274-281.
J. A. Smith, S. S. Howards, G. M. Preminger, and R. R. Dmochowski, Hinman’s Atlas of Urologic Surgery Revised Reprint. Elsevier, 2019.
Zhu, S.; Zhang, H.; Xie, L.; Chen, J. & Niu, Y.
Risk
Factors and Prevention of Inguinal Hernia after Radical Prostatectomy: A
Systematic Review and Meta-analysis.
J Urol, 2012.
 English Version: Surgical technique and complications of radical retropubic prostatectomy
English Version: Surgical technique and complications of radical retropubic prostatectomy
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.