Sie sind hier: Startseite > Medikamente > antiandrogene Hormontherapie > Bicalutamid
Antiandrogene Hormontherapie mit Bicalutamid: Nebenwirkungen und Dosierung
- Antiandrogene Hormontherapie: Chemische Einteilung, Nebenwirkungen
- Antiandrogene Hormontherapie: Flutamid
- Antiandrogene Hormontherapie: Bicalutamid
- Antiandrogene Hormontherapie: GnRH-Agonisten
- Antiandrogene Hormontherapie: GnRH-Antagonisten
- Hemmer der Testosteronsynthese: Abirateron
- Antiandrogen Enzalutamid
- Antiandrogen Apalutamid
- Antiandrogen Darolutamid
Indikationen für Bicalutamid
Die antiandrogene Therapie mit Bicalutamid ist eine Therapieoption gegen das Prostatakarzinom in folgenden Situationen:
- Kurzfristige Gabe von bei Beginn einer Therapie mit GnRH-Analoga.
- Hormontherapie des metastasierten Prostatakarzinoms, als Alternative oder in Kombination mit der operativen oder medikamentösen Kastration. Siehe Abb. Therapieoptionen bei fortgeschrittenen Prostatakarzinom.
- Adjuvante Therapie des fortgeschrittenen Prostatakarzinom nach operativer Therapie oder nach Strahlentherapie.
- Konservative Therapie eines lokal fortgeschrittenen Prostatakarzinoms mit LUTS.
Wirkmechanismus von Bicalutamid:
Nichtsteroidales Antiandrogen, kompetetiver Antagonismus am Androgenrezeptor. Durch die zentrale Hemmung der Androgenrezeptoren kommt es zu einem Anstieg von LH, Testosteron und Östrogen.
Pharmakokinetik von Bicalutamid:
Gute Resorption, über 95 % Bindung an Proteine, hepatische Metabolisierung, renale und biliäre Ausscheidung. Halbwertszeit 1,3 Tage, einzelne Metaboliten deutlich länger. Effektive Halbwertszeit von Bicalutamid ungefähr 7 Tage.
Nebenwirkungen von Bicalutamid:
von den Nebenwirkungen der Antiandrogene sind für Bicalutamid typisch: Gynäkomastie (50–70 %), weiterhin Hitzewallungen, verminderte Libido, verminderte Erektionsfähigkeit (erektile Dysfunktion) sehr häufig, aber geringer ausgeprägt als unter GnRH-Therapie.
Weitere Nebenwirkungen:
- Bauchschmerzen, Diarrhoe oder Übelkeit häufig, selten Erbrechen.
- Leberenzymerhöhung (7%) oder Ikterus.
- Flüssigkeitsretention, kardiale Dekompensation
- Anämie häufig, selten Leukopenie, Thrombozytopenie
- Allergische Reaktionen
Wechselwirkungen von Bicalutamid:
Marcumar (Verdrängung aus der Proteinbindung), Terfenadin oder Cisaprid (Hemmung von Cytochromen).
Kontraindikationen für Bicalutamid:
Bei Leberinsuffizienz zumindest Dosisreduktion und regelmäßige Laborkontrollen, bei progredienter Transaminasenerhöhung ohne Nachweis von Lebermetastasen Absetzen von Bicalutamid. Allergie. Frauen und Kinder.
Dosierung von Bicalutamid:
In Deutschland ist Casodex für 50 mg 1–0–0 p.o. oder 150 mg 1–0–0 p.o. zugelassen. Zur antiandrogenen Monotherapie wird 150 mg/d empfohlen. Zur Verhinderung der Testosteronwirkung bei Beginn einer GnRH-Therapie (siehe unten) oder in Kombination mit einer GnRH-Therapie (komplette Androgenblockade) reicht 50 mg 1–0–0.
| Flutamid | suchen | GnRH Hormontherapie |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur Bicalutamid
Anderson 2003 ANDERSON, J.: The role of antiandrogen monotherapy in the treatment of prostate cancer.In: BJU Int
91 (2003), Nr. 5, S. 455–61.
Diamond u.a. 2004 DIAMOND, T. H. ; HIGANO,
C. S. ; SMITH, M. R. ; GUISE, T. A. ; SINGER,
F. R.:
Osteoporosis in men with prostate carcinoma receiving
androgen-deprivation therapy: recommendations for diagnosis and therapies.
In: Cancer
100 (2004), Nr. 5, S. 892–9.
Fradet u.a. 2007 FRADET, Yves ; EGERDIE,
Blair ; ANDERSEN, Morten ; TAMMELA, Teuvo L J. ;
NACHABE, Mahmoud ; ARMSTRONG, Jon ; MORRIS,
Thomas ; NAVANI, Sunil:
Tamoxifen as prophylaxis for prevention of gynaecomastia and breast
pain associated with bicalutamide 150 mg monotherapy in patients with
prostate cancer: a randomised, placebo-controlled, dose-response study.
In: Eur Urol
52 (2007), Jul, Nr. 1, S. 106–114.
Loblaw u.a. 2004 LOBLAW, D. A. ; MENDELSON,
D. S. ; TALCOTT, J. A. ; VIRGO, K. S. ;
SOMERFIELD, M. R. ; BEN-JOSEF, E. ; MIDDLETON,
R. ; PORTERFIELD, H. ; SHARP, S. A. ; SMITH,
T. J. ; TAPLIN, M. E. ; VOGELZANG, N. J. ; WADE,
Jr. ; BENNETT, C. L. ; SCHER, H. I.:
American Society of Clinical Oncology recommendations for the initial
hormonal management of androgen-sensitive metastatic, recurrent, or
progressive prostate cancer.
In: J Clin Oncol
22 (2004), Nr. 14, S. 2927–41.
Miyamoto u.a. 2004 MIYAMOTO, H. ; MESSING,
E. M. ; CHANG, C.:
Androgen deprivation therapy for prostate cancer: current status and
future prospects.
In: Prostate
61 (2004), Nr. 4, S. 332–53.
Perdona u.a. 2005 PERDONA, S. ; AUTORINO, R. ;
DE PLACIDO, S. ; D’ARMIENTO, M. ; GALLO, A. ;
DAMIANO, R. ; PINGITORE, D. ; GALLO, L. ;
DE SIO, M. ; BIANCO, A. R. ; DI LORENZO, G.:
Efficacy of tamoxifen and radiotherapy for prevention and treatment
of gynaecomastia and breast pain caused by bicalutamide in prostate cancer: a
randomised controlled trial.
In: Lancet Oncol
6 (2005), Nr. 5, S. 295–300.
Sieber u.a. 2004 SIEBER, P. R. ; KEILLER,
D. L. ; KAHNOSKI, R. J. ; GALLO, J. ; MCFADDEN,
S.:
Bicalutamide 150 mg maintains bone mineral density during monotherapy
for localized or locally advanced prostate cancer.
In: J Urol
171 (2004), Nr. 6 Pt 1, S. 2272–6, quiz 2435
Smith u.a. 2004b SMITH, M. R. ;
GOODE, M. ; ZIETMAN, A. L. ; MCGOVERN, F. J. ;
LEE, H. ; FINKELSTEIN, J. S.:
Bicalutamide monotherapy versus leuprolide monotherapy for prostate
cancer: effects on bone mineral density and body composition.
In: J Clin Oncol
22 (2004), Nr. 13, S. 2546–53.
Tyrrell u.a. 2004 TYRRELL, C. J. ; PAYNE, H. ;
TAMMELA, T. L. ; BAKKE, A. ; LODDING, P. ;
GOEDHALS, L. ; VAN ERPS, P. ; BOON, T. ;
VAN DE BEEK, C. ; ANDERSSON, S. O. ; MORRIS, T. ;
CARROLL, K.:
Prophylactic breast irradiation with a single dose of electron beam
radiotherapy (10 Gy) significantly reduces the incidence of
bicalutamide-induced gynecomastia.
In: Int J Radiat Oncol Biol Phys
60 (2004), Nr. 2, S. 476–83.
Widmark u.a. 2003 WIDMARK, A. ; FOSSA, S. D. ;
LUNDMO, P. ; DAMBER, J. E. ; VAAGE, S. ;
DAMBER, L. ; WIKLUND, F. ; KLEPP, O.:
Does prophylactic breast irradiation prevent antiandrogen-induced
gynecomastia? Evaluation of 253 patients in the randomized Scandinavian trial
SPCG-7/SFUO-3.
In: Urology
61 (2003), Nr. 1, S. 145–51.
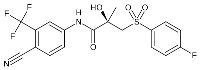
 English Version: Bicalutamide
English Version: Bicalutamide
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.