Sie sind hier: Startseite > Prostata > Prostatakarzinom > Hormontherapie
Prostatakarzinom: Hormontherapie der Metastasen
- Prostatakarzinom: Definition, Epidemiologie und Ursachen
- Prostatakarzinom: Pathologie
- Prostatakarzinom: Klinik, Vorsorgeuntersuchung, PSA
- Prostatakarzinom: Diagnose, Bildgebung, Staging
- Prostatakarzinom: Therapieübersicht, aktive Überwachung
- Prostatakarzinom: Operation
- Prostatakarzinom: Therapie (Strahlentherapie)
- Prostatakarzinom: Therapie (Brachytherapie, Kryotherapie, HIFU)
- Prostatakarzinom: kastrationssensibles Prostatakarzinom
- Prostatakarzinom: kastrationsresistentes Prostatakarzinom, Prävention
Das fortgeschrittene Prostatakarzinom wird in Abhängigkeit des Ansprechens auf die Standardhormontherapie und den Ergebnissen in der Bildgebung in unterschiedliche Stadien eingeteilt. Durch Zulassungsstudien wurden weitere Krankheitsstadien definiert, um die Indikationen für die moderne Hormontherapie genau einzugrenzen:
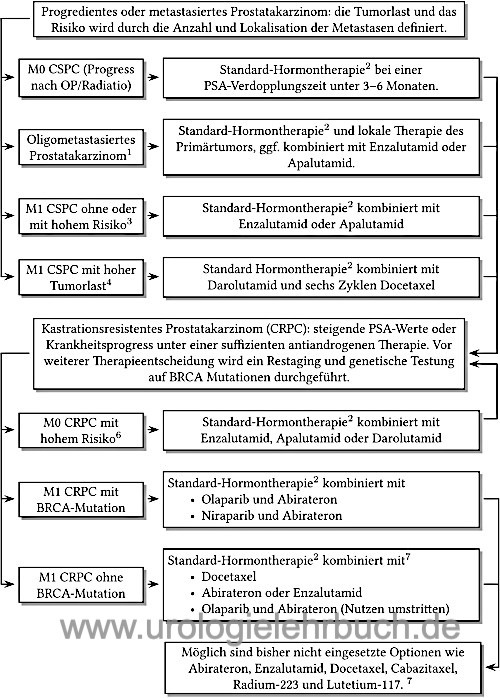
- Kastrationssensibles Prostatakarzinom: fortgeschrittenes Prostatakarzinom (biochemischer Progress oder nachgewiesene Metastasen) mit Ansprechen auf die Androgendeprivation (siehe unten), engl. castrastion-sensible prostate cancer (CSPC). Je nach Nachweis von Metastasen in der Bildgebung wird vom Stadium M0 CSPC oder M1 CSPC gesprochen. Schwierig ist die Unterscheidung des Stadiums M0 CSPC von einem Lokalrezidiv nach kurativer Therapie, hilfreich ist dabei die Histologie und der PSA-Verlauf (siehe Tab. Prognosefaktoren PSA-Rezidiv nach Prostatektomie.
- M1 CSPC mit hoher Tumorlast: kastrationssensibles Prostatakarzinom mit mindestens 4 Knochenmetastasen (davon mindestens eine jenseits von Becken oder Wirbelsäule) oder das Vorliegen von viszeralen Metastasen.
- M1 CSPC mit hohem Risiko: kastrationssensibles Prostatakarzinom mit mindestens zwei der folgenden Risikofaktoren: Gleason-Score ≥8, mindestens 3 Knochenmetastasen, Nachweis von viszeralen Metastasen.
- Oligometastasiertes Prostatakarzinom: gering metastasiertes kastrationssensibles Prostatakarzinom mit maximal 2–4 sichtbaren Knochenmetastasen (je nach Studie) in der konventionellen Bildgebung.
- Kastrationsresistentes Prostatakarzinom: fortgeschrittenes Prostatakarzinom mit biochemischen Progress oder zunehmende Metastasierung in der Bildgebung trotz suffizienter Androgendeprivation, engl. castrastion-resistant prostate cancer (CSPC).
- M0 CRPC: biochemischer Progress des Prostatakarzinoms unter suffizienter Androgendeprivation und ohne Nachweis von Metastasen in der Bildgebung.
- M0 CRPC mit hohem Risiko: M0 CRPC mit einer PSA-Verdoppelungszeit von unter 10 Monaten.
- M1 CRPC: Progress des Prostatakarzinoms unter suffizienter Androgendeprivation und mit Nachweis von Metastasen in der Bildgebung.
Prognose des metastasierten Prostatakarzinoms:
Prognostisch günstig sind eine geringe Tumorlast, keine Schmerzen, keine viszerale Metastasen, metachrone Metastasen nach zuvor durchgeführte Lokaltherapie, niedriger Gleasonscore, niedrige PSA-Konzentration, gutes PSA-Ansprechen nach antiandrogener Therapie und eine lange PSA-Verdoppelungszeit, siehe auch Tab. Prognose des metastasierten Prostatakarzinom.
| Zeit bis CRPC | Überlebenszeit | |
| LT/LV | 26 Monate | 92 Monate |
| LT/HV | 15 Monate | 55 Monate |
| DN/LV | 18 Monate | 52 Monate |
| DN/HV | 12 Monate | 43 Monate |
Therapieoptionen für das fortgeschrittene oder metastasierte Prostatakarzinom
Folgende Optionen existieren für die Therapie des fortgeschrittenen und metastasierten Prostatakarzinoms:
- Chirurgische Androgendeprivation: bilaterale subkapsuläre Orchiektomie
- Medikamentöse Androgendeprivation mit
- GnRH-Analoga (Buserelin, Goserelin, Histrelin, Leuprorelin, Triptorelin)
- GnRH-Antagonisten (Degarelix und Relugolix)
- Nichtsteroidale Androgenrezeptorantagonisten (Flutamid, Bicalutamid)
- Chemotherapie mit Docetaxel, Zweitlinientherapie mit Cabazitaxel
- Androgensynthesehemmer (Abirateron)
- Moderne Androgenrezeptorantagonisten (Enzalutamid, Apalutamid, Darolutamid)
- PARP-Inhibitoren (Olaparib, Niraparib)
- Strahlentherapie oder operative Stabilisierung von Metastasen
- Intravenöse Radionuklide
- Hemmung der Osteoklasten mit Zoledronat oder Denosumab
- Strahlentherapie oder operative Therapie des Primärtumors bei oligometastasierten Patienten
Die einzelnen Therapieoptionen werden in Abhängigkeit des Krankheitsprogress und Ansprechen sequenziell oder kombiniert angewendet [Abb. Hormontherapie]. Siehe auch Kapitel Antiandrogene Therapie (Albers u.a., 2020).
Kastrationssensibles Prostatakarzinom (CSPC)
Indikationen für eine antiandrogene Therapie:
Die S3-Leitlinie für das Prostatakarzinom empfiehlt die Hormontherapie bei biochemischen Progress mit einer PSA-Verdopplungszeit < 3 Monate, symptomatischer lokaler Progression, bei nachgewiesener Fernmetastasierung und adjuvant im Rahmen einer Strahlentherapie oder bei (ausgedehnter) Lymphknotenmetastasierung nach radikaler Prostatektomie [S3-Leitlinie Prostatakarzinom].
Standard Androgendeprivation:
Am häufigsten wird die Androgendeprivation mit Hilfe von GnRH-Analoga (Goserelin, Leuprorelin) durchgeführt. Da bei Therapiebeginn ein passagerer Anstieg der Testosteronkonzentration entsteht, wird zusätzlich für 2–4 Wochen Flutamid oder Bicalutamid p.o. verabreicht. GnRH-Analoga stehen in Form von Depot-Injektionen (alle 1–6 Monate in Abhängigkeit des Präparates) zur Verfügung. Weitere Alternativen der Androgendeprivation: subkapsuläre Orchiektomie bds, Monotherapie mit nichtsteroidalen Androgenrezeptorantagonisten (Flutamid, Bicalutamid) oder GnRH-Antagonisten.
Vergleichende Studien für die Hormontherapie des Prostatakarzinoms:
Im Vergleich zur Orchiektomie sind die GnRH-Analoga onkologisch gleichwertig, die Androgenrezeptorantagonisten nur gering unterlegen. Das Nebenwirkungsprofil der Androgenrezeptorantagonisten ist günstiger. GnRH-Antagonisten senken schneller die Testosteronkonzentration als GnRH-Analoga, sind aber schlechter verträglich und müssen monatlich verabreicht werden.
Nebenwirkungen der Hormontherapie:
Zu den Nebenwirkungen der antiandrogenen Therapie und deren Prophylaxe durch eine adjuvante Therapie siehe Kapitel Antiandrogene Therapie.
Nachsorge:
Die Standard-Bildgebung zum Nachweis von Metastasen besteht in einem CT Abdomen und Thorax und einer Knochenszintigraphie. Der Zusatznutzen der modernen Bildgebung (PSMA-PET) ist noch unklar. Bei Progress der Erkrankung zum CRPC sollte die Bildgebung wiederholt werden.
Laborkontrollen: alle 3–6 Monate PSA-Konzentration. Je nach Symptomatik oder V.a. Progress zusätzlich Blutbild, Kreatinin, Leberwerte, AP und Testosteron.
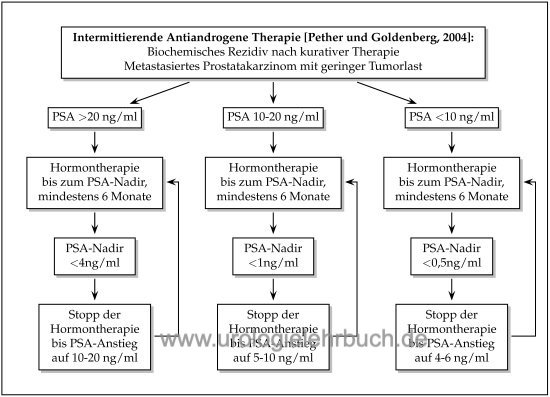
Intermittierende Hormontherapie des Prostatakarzinoms:
Ziel der intermittierenden Hormontherapie ist die Senkung der Nebenwirkungsrate durch Minimierung der Zeit unter Hormontherapie, dies ist für die Libido, Erektion, Hitzewallungen und allg. körperliches Wohlbefinden durch Studien belegt. Die Hormontherapie wird in Abhängigkeit der Ausgangs-PSA-Konzentration bis zu einem bestimmten PSA-Nadir durchgeführt, dann folgt eine Therapiepause bis zu einem bestimmten PSA-Progress, welcher wieder die Indikation zu einem weiteren Zyklus Hormontherapie festlegt [Abb. Flussdiagramm intermittierende Hormontherapie beim Prostatakarzinom] (Pether and Goldenberg, 2004). Die Testosteronkonzentration erreicht auch nach mehreren Zyklen Hormontherapie wieder Normalwerte.
Die Studienlage ist bezüglich der Gleichwertigkeit der intermittierenden Hormontherapie im Vergleich zur kontinuierlichen Hormontherapie uneindeutig. Mehrere randomisierte Studien haben die onkologische Gleichwertig demonstriert (Crook u.a., 2012) (Mottet u.a., 2012) (Salonen u.a., 2012). In der größten randomisierten Studie (SWOG 9346, n=1535) zeigte sich jedoch in der Gruppe der intermitterenden Hormontherapie eine geringere Lebenserwartung (5,1 vs. 5,8 Jahre, 7JÜR 38% vs. 42%), dieser Effekt war in der Gruppe der geringmetastasierten Patienten noch stärker (Hussain, 2012).
 |
Lokale Therapie bei metastasiertem Prostatakarzinom:
Bei oligometastasierten Patienten führt die Strahlentherapie des Primärtumors (zusätzlich zur systemischen Hormontherapie und ggf. Strahlentherapie einzelner Metastasen) zu einer besseren Überlebensrate von 7% innerhalb von 3 Jahren (Burdett u.a., 2019). Ein onkologischer Vorteil der radikalen Prostatektomie bei oligometastasierten Patienten ist nicht hinreichend belegt, sie ist aber eine Option in ausgewählten Fällen (Leyh u.a., 2017), insbesondere bei Harnverhalt oder lokalen Beschwerden.
Chemotherapie des metastasierten hormonsensitiven Prostatakarzinoms mit hoher Tumorlast:
Bis vor kurzem gab es keine gesicherten erfolgreichen Therapiekonzepte, Chemotherapeutika alleine oder in Kombination mit einer Hormontherapie bei einem hormonsensiblen Prostatakarzinom einzusetzen. Dies hat sich mit der Publikation der STAMPEDE- und CHAARTED-Studie geändert (Gillessen u.a., 2015). Die Chemotherapie sollte innerhalb der ersten Monate nach Beginn der Hormontherapie begonnen werden.
In CHAARTED-Studie wurden 790 Männer randomisiert: eine Gruppe erhielt die Standardhormontherapie mit GnRH-Antagonisten oder Analoga, die zweite Gruppe erhielt zusätzlich zur Hormontherapie 6 Zyklen Docetaxel Chemotherapie. In der Gruppe mit hoher Tumorlast zeigte sich ein deutlicher Überlebensvorteil von 17 Monaten für Docetaxel zusätzlich zur Hormontherapie (MÜZ 49 vs. 32 Monate). Als hohe Tumorlast wurden mindestens 4 Knochenmetastasen oder das Vorliegen von viszeralen Metastasen definiert (Sweeney u.a., 2015). In der STAMPEDE-Studie wurden 2962 Männer randomisiert: Hormontherapie versus zusätzlich Docetaxel (6 Zyklen) versus zusätzlich Zoledronsäure versus zusätzlich Docetaxel und Zoledronsäure. Die Kombination der Hormontherapie mit Docetaxel verlängerte das Überleben um zehn Monate (71 versus 81 Monate), die Zoledronsäure zeigte keine Verbesserung des Überlebens (James u.a., 2016). Im Gegensatz zur STAMPEDE- und CHAARTED-Studie konnte in der GETUG 15-Studie kein Vorteil im Gesamtüberleben demonstriert werden (Gravis u.a, 2013).
Dreifachkombinationen bei M1 CSPC mit hoher Tumorlast:
In randomisierten Studien zeigte die Dreifachkombination aus Standardhormontherapie intensiviert mit Abirateron oder Darolutamid und Docetaxel-Chemotherapie Vorteile hinsichtlich Überleben und Krankheitsprogression. Die Tripletherapie in der PEACE-1 Studie (Hormontherapie + Abirateron + Docetaxel) führte zu einem besseren Überleben (HR 0,75) und verlängertem progressionsfreien Überleben (HR 0,5) verglichen mit Hormontherapie und Docetaxel (Fizazi u.a., 2022). Die Tripletherapie in der ARASENS Studie (Hormontherapie + Darolutamid + Docetaxel) führte zu einem besseren Überleben (HR 0,68) und verlängertem progressionsfreien Überleben verglichen mit Hormontherapie und Docetaxel (Smith u.a., 2022a). Die zusätzlichen Nebenwirkungen durch die intensivierte Hormontherapie sind akzeptabel und wahrscheinlich mit Darolutamid geringer als mit Abirateron. Die Tripletherapie mit Darolutamid ist in den USA seit 2022 und in Europa seit 2023 zugelassen und gilt als neuer Standard bei Patienten mit hoher Tumorlast.
Kombinierte Hormontherapie (Androgendeprivation kombiniert mit Enzalutamid) des metastasierten hormonsensitiven Prostatakarzinoms:
Die randomisierte Studien ENZAMET (n=1125) konnte nachweisen, dass die Androgendeprivation kombiniert mit Enzalutamid das Gesamtüberleben verbessert (102 versus 143 Todesfälle nach drei Jahren) und die Krankheitsprogression verlangsamt (Davis u.a., NEJM 2019). Die Vorteile konnten in allen Risikogruppen nachgewiesen werden. In der ARCHES-Studie konnten diese Daten bestätigt werden (Armstrong u.a., 2021), Enzalutamid ist seit 5/2021 zur Therapie des hormonsensitiven Prostatakarzinoms in allen Risikogruppen zugelassen.
Kombinierte Hormontherapie (Androgendeprivation kombiniert mit Apalutamid) des metastasierten hormonsensitiven Prostatakarzinoms:
Die randomisierte Studien TITAN (n=1052) konnte zeigen, dass die Androgendeprivation kombiniert mit Apalutamid das Gesamtüberleben verbessert (HR 0,67) und die Krankheitsprogression verlangsamt (HR 0,48) (Chi u.a., NEJM 2019). Die Vorteile konnten in allen Risikogruppen nachgewiesen werden. Apalutamid ist seit 1/2020 zur Therapie des hormonsensitiven Prostatakarzinoms in allen Risikogruppen zugelassen.
Kombinierte Hormontherapie (Androgendeprivation kombiniert mit Abirateron) des metastasierten hormonsensitiven Prostatakarzinoms mit hohem Risiko:
Die Zulassung von Abirateron wurde 2017 aufgrund der Ergebnisse der STAMPEDE (James u.a., 2017) und der LATITUDE (Fizazi u.a., 2017) erweitert. Die Erweiterung der klassischen antiandrogenen Therapie mit Abirateron 1000 mg/d und Prednisolon 5 mg/d führte zu einer verbesserten Überlebensrate (83 vs. 76% und 66% vs. 59%) und einem verlängertem progressionsfreien Überleben und verlängerter Zeit bis zum Beginn einer Chemotherapie. Aufgrund der wichtigen Rolle von Abirateron im kastrationsresistentem Stadium (in Kombination mit Olaparib) sollte die Verordnung bei Patienten mit CSPC zurückhaltend gesehen werden.
| Prostatakarzinom: Brachytherapie und HIFU | Suchen | Kastrationsresistentes Prostatakarzinom |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Akduman und Crawford 2003 AKDUMAN, B. ; CRAWFORD, E. D.: The management of high risk prostate cancer.In: J Urol
169 (2003), Nr. 6, S. 1993–8
EAU Guidelines
EAU - EANM - ESTRO - ESUR - SIOG Guidelines on
Prostate Cancer, https://uroweb.org/guidelines/prostate-cancer/.
Fizazi, K.; Tran, N.; Fein, L.; Matsubara, N.;
Rodriguez-Antolin, A.; Alekseev, B. Y.; Özgüroğlu, M.; Ye, D.; Feyerabend,
S.; Protheroe, A.; De Porre, P.; Kheoh, T.; Park, Y. C.; Todd, M. B.; Chi,
K. N. & Investigators, L.
Abiraterone plus Prednisone in
Metastatic, Castration-Sensitive Prostate Cancer.
The New England
journal of medicine, 2017, 377, 352-360
I. D. Davis et al.
“Enzalutamide with Standard First-Line Therapy in Metastatic Prostate Cancer.,” The New England journal of medicine, vol. 381, no. 2, pp. 121–131, 2019.
Halabi u.a. 2003 HALABI, S. ; SMALL, E. J. ;
KANTOFF, et a.:
Prognostic model for predicting survival in men with
hormone-refractory metastatic prostate cancer.
In: J Clin Oncol
21 (2003), Nr. 7, S. 1232–7
Hussain, M.
Intermittent (IAD) versus continuous
androgen deprivation (CAD) in hormone sensitive metastatic prostate cancer
(HSM1PC) patients (pts): Results of S9346 (INT-0162), an international
phase III trial.
J Clin Oncol, 2012, 30 (suppl;
abstr 4).
James, N. D.; Sydes, M. R.; Clarke, N. W.; Mason, M.
D.; Dearnaley, D. P.; Spears, M. R.; Ritchie, A. W. S.; Parker, C. C.;
Russell, J. M.; Attard, G.; de Bono, J.; Cross, W.; Jones, R. J.;
Thalmann, G.; Amos, C.; Matheson, D.; Millman, R.; Alzouebi, M.; Beesley,
S.; Birtle, A. J.; Brock, S.; Cathomas, R.; Chakraborti, P.; Chowdhury,
S.; Cook, A.; Elliott, T.; Gale, J.; Gibbs, S.; Graham, J. D.;
Hetherington, J.; Hughes, R.; Laing, R.; McKinna, F.; McLaren, D. B.;
O'Sullivan, J. M.; Parikh, O.; Peedell, C.; Protheroe, A.; Robinson, A.
J.; Srihari, N.; Srinivasan, R.; Staffurth, J.; Sundar, S.; Tolan, S.;
Tsang, D.; Wagstaff, J.; Parmar, M. K. B. & , S. T. A. M. P. E. D. E.
Addition
of docetaxel, zoledronic acid, or both to first-line long-term hormone
therapy in prostate cancer (STAMPEDE): survival results from an adaptive,
multiarm, multistage, platform randomised controlled trial.
Lancet 2016, 387,
1163-1177.
James, N. D.; de Bono, J. S.; Spears, M. R.;
Clarke, N. W.; Mason, M. D.; Dearnaley, D. P.; Ritchie, A. W. S.; Amos, C.
L.; Gilson, C.; Jones, R. J.; Matheson, D.; Millman, R.; Attard, G.;
Chowdhury, S.; Cross, W. R.; Gillessen, S.; Parker, C. C.; Russell, J. M.;
Berthold, D. R.; Brawley, C.; Adab, F.; Aung, S.; Birtle, A. J.; Bowen,
J.; Brock, S.; Chakraborti, P.; Ferguson, C.; Gale, J.; Gray, E.;
Hingorani, M.; Hoskin, P. J.; Lester, J. F.; Malik, Z. I.; McKinna, F.;
McPhail, N.; Money-Kyrle, J.; O'Sullivan, J.; Parikh, O.; Protheroe, A.;
Robinson, A.; Srihari, N. N.; Thomas, C.; Wagstaff, J.; Wylie, J.; Zarkar,
A.; Parmar, M. K. B.; Sydes, M. R. & STAMPEDE Investigators
Abiraterone
for Prostate Cancer Not Previously Treated with Hormone Therapy.
The
New England journal of medicine, 2017, 377, 338-351.
Loblaw u.a. 2004 LOBLAW, D. A. ; MENDELSON,
D. S. ; TALCOTT, J. A. ; VIRGO, K. S. ;
SOMERFIELD, M. R. ; BEN-JOSEF, E. ; MIDDLETON,
R. ; PORTERFIELD, H. ; SHARP, S. A. ; SMITH,
T. J. ; TAPLIN, M. E. ; VOGELZANG, N. J. ; WADE,
Jr. ; BENNETT, C. L. ; SCHER, H. I.:
American Society of Clinical Oncology recommendations for the initial
hormonal management of androgen-sensitive metastatic, recurrent, or
progressive prostate cancer.
In: J Clin Oncol
22 (2004), Nr. 14, S. 2927–41
Mottet, Nicolas; Damme, Jean Van; Loulidi, Salim; Russel, Christoph; Leitenberger, Armin; Wolff, Johannes M & the TAP22 Investigators Group Intermittent hormonal therapy in the treatment of metastatic prostate cancer: a randomized trial.
BJU Int, 2012.
M. Pether and S. L. Goldenberg.
Intermittent androgen suppression.
BJU Int, 93 (3): 258–261, Feb 2004.
Pound u.a. 1999 POUND, C. R. ; PARTIN, A. W. ;
EISENBERGER, M. A. ; CHAN, D. W. ; PEARSON,
J. D. ; WALSH, P. C.:
Natural history of progression after PSA elevation following radical
prostatectomy.
In: Jama
281 (1999), Nr. 17, S. 1591–7
Leitlinienprogramm Onkologie (DGU, Deutsche Krebsgesellschaft, Deutsche Krebshilfe):
Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms https://www.leitlinienprogramm-onkologie.de/leitlinien/prostatakarzinom/
Wein, A. J.; Kavoussi, L. R.; Partin, A. P. & Peters, C. A.
Campbell-Walsh Urology
. Elsevier, 2015. ISBN 978-1455775675.
Salonen, A. J.; Taari, K.; Ala-Opas, M.; Viitanen, J.;
Lundstedt, S.; Tammela, T. L. J. & Group, F.
The FinnProstate Study
VII: intermittent versus continuous androgen deprivation in patients with
advanced prostate cancer.
J Urol, 2012, 187,
2074-2081.
Smaletz u.a. 2002 SMALETZ, O. ; SCHER, H. I. ;
SMALL, E. J. ; VERBEL, D. A. ; MCMILLAN, A. ;
REGAN, K. ; KELLY, W. K. ; KATTAN, M. W.:
Nomogram for overall survival of patients with progressive metastatic
prostate cancer after castration.
In: J Clin Oncol
20 (2002), Nr. 19, S. 3972–82
 English Version: Hormonal therapy of metastatic prostate cancer
English Version: Hormonal therapy of metastatic prostate cancer
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.