Sie sind hier: Startseite > Hoden > Hodentumoren > Therapie
Stadienabhängige Therapie von Nichtseminomen nach Leitlinien
- Hodentumor: Ursachen und Pathologie
- Hodentumor: Tumorstadien und Klinik
- Hodentumor: Diagnose
- Hodentumor: Therapie der Seminome
- Hodentumor: Therapie der Nichtseminome, Prognose
Eine Übersicht über die stadienabhängigen Therapieoptionen bei Hodentumoren zeigt Tab. Therapieübersicht der Hodentumoren in Abhängigkeit des klinischen Stadiums:
| Stadium | Seminom | Nichtseminom |
| Stadium IA Stadium IB |
Aktive Überwachung oder 1 Zyklus Carboplatin (hohes Risiko) |
Aktive Überwachung oder 1 Zyklus PEB (hohes Risiko) oder nerverhaltende RLA |
| Stadium IS | Strahlentherapie (30 Gy) oder 1–3 Zyklen PEB |
1–3 Zyklen PEB |
| Stadium IIA | Strahlentherapie (30 Gy) oder 3 Zyklen PEB |
Positive Tumormarker: 3 Zyklen PEB Negative Tumormarker: nervenschonende RLA oder Restaging (CT) in sechs Wochen (siehe Text). |
| Stadium IIB-III (gute Prognose) |
3 Zyklen PEB | 3 Zyklen PEB |
| Stadium IIB-III (mittlere Prognose) |
4 Zyklen PEB | 4 Zyklen PEB |
| Stadium IIB-III (schlechte Prognose) |
- | 4 Zyklen PEB oder Hochdosis-Chemotherapie in Studien |
| Residualtumor nach Chemotherapie | RLA nur bei PET-aktiven Resttumoren über 3 cm | RLA bei Resttumoren > 1–2 cm |
Therapie des Nichtseminoms Stadium I
Die Gefäßinvasion im Orchiektomiepräparat ist ein entscheidender Risikofaktor für die Progression und definiert folgende Risikogruppen: 14–22 % Progression ohne Gefäßinvasion (Niedrigrisiko-Nichtseminom Stadium I) vs. 48 % Progression mit Gefäßinvasion (Hochrisiko-Nichtseminom Stadium I). Die Therapie des Nichtseminoms Stadium I mit allen hier vorgestellten Optionen resultiert in einer Heilungsrate von 99 %.
Niedrigrisiko Nichtseminom Stadium I:
die Standardtherapie besteht in der engmaschigen Überwachung (watchful waiting), da das niedrige Risiko der Progression keine Therapie mit Nebenwirkungen akzeptabel macht. Die Nachsorgen beinhalten mehrere CT-Untersuchungen, siehe Empfehlungen der Nachsorge bei Hodentumoren (s.u.). Nachteilig sind der psychische Stress der initialen Nichttherapie, ungefähr 20 % der Patienten benötigen drei Zyklen PEB bei Progress.
Eine engmaschige Überwachung ist keine gute Option bei Patienten mit großer Tumorangst, hohem Therapiewunsch oder schlechter Compliance. In dieser Situation sollte eine adjuvante Chemotherapie mit einem Zyklus PEB empfohlen werden (Beyer u.a., 2013).
In erfahrenen Händen ist die nervenschonende RLA die dritte Therapieoption, falls Überwachung oder adjuvante Chemotherapie nicht gewünscht wird. Im direkten Vergleich mit einem Zyklus PEB existieren jedoch onkologische Vorteile für die adjuvante Chemotherapie (1,1 % vs. 7,5 % Rezidiv). Als weiterer Nachteil der RLA ist die chirurgische Morbidität von 9 % zu nennen.
Hochrisiko-Nichtseminom Stadium I:
Die adjuvante Chemotherapie mit einem Zyklus PEB bietet die beste Kosten-Nutzen-Relation, die ehemalige Dosierung von zwei Zyklen wird in den aktuellen Leitlinien nicht mehr empfohlen. Das Rezidivrisiko wird auf 3 % gesenkt, die Heilungsrate beträgt 99 %. Alternativ genügt die prophylaktische Gabe von einem Zyklus PEB, da neuere Daten vergleichbare Ergebnisse zeigten (Tandstad u.a., 2013). Nachteilig ist die Übertherapie von ungefähr der Hälfte der Patienten. Die Langzeitfolgen von PEB Chemotherapie für einen jungen Menschen sind hinsichtlich der Induktion von Zweitmalignomen ungewiss. Alternativ wird eine aktive Überwachung oder eine nervenschonende RLA durchgeführt (s.o.).
Teratome mit maligner somatischer Transformation:
Teratome mit maligner somatischer Transformation sprechen schlecht auf eine Chemotherapie an und haben eine schlechte Prognose. Im Stadium I sollte eine RLA durchgeführt werden, sie bietet Chance auf Heilung. Die 5JÜR liegt zwischen 80–90% (Giannatempo u.a., 2016).
Therapie des Nichtseminoms Stadium IS
Bei persistierenden pathologischen Hodentumormarkern (nach Orchiektomie) im Stadium I ist eine Chemotherapie vergleichbar mit Stadium IB–IIA indiziert. Es existieren keine genauen Empfehlungen bezüglich der Dosierung der Chemotherapie (1–3 Zyklen), sie sollten individuell und von der Höhe der Tumormarker abhängig gemacht werden.
Therapie des Nichtseminoms Stadium IIA/IIB
Die Therapie nach Leitlinien führt zu einer Heilungsrate um 98 %. Der Therapiealgorithmus unterscheidet zwischen einem marker-positiven Nichtseminom (AFP, HCG oder LDH persistierend pathologisch nach Orchiektomie) oder marker-negativen Nichtseminom (Tumormarker im Normbereich nach der Orchiektomie).
Marker-positives Nichtseminom Stadium IIA und alle Stadium IIB:
Standardtherapie sind 3–4 Zyklen PEB, je nach Höhe der Tumormarker (siehe Kriterien der IGCCCG). Marker-negative Residualtumoren nach Chemotherapie von über 1 cm Durchmesser werden mit einer RLA entfernt (siehe unten). Viele Patienten erreichen eine Vollremission und benötigen keine RLA (83–91 % im Stadium IIA, 61–87 % im Stadium IIB). Das Rezidivrisiko beträgt im Stadium IIA 4–9 %, bei IIB 11–15 %.
Marker-negatives Nichtseminom Stadium IIA:
istgesamt selten. Marker-negative Nichtseminome im Stadium IIA sind v. a. das Teratom, das reine embryonale Karzinom oder Mischtumoren. Weiterhin müssen gutartige Lymphknotenvergrößerungen in Betracht gezogen werden. Zwei Therapieoptionen exisitieren: sofortige RLA oder Restaging nach 6 Wochen.
Nervensparende RLA:
Keine weitere Therapie ist notwendig bei benigner Histologie oder Teratom. Bei Nachweis von Lymphknotenmetastasen (Schnellschnittdiagnose) wird die kontralaterale Dissektion durchgeführt, alternativ Gabe von 1–2 Zyklen PEB, dadurch werden okkulte Metastasen in der Lunge (um 25%) mitbehandelt. Nach bilateraler RLA ohne adjuvante Chemotherapie engmaschige Nachsorgen insbesondere der Lunge und drei Zyklen PEB bei nachgewiesenem Progress.
Restaging nach 6 Wochen:
erneutes CT-Abdomen zur erneuten Beurteilung der vergrößerten Lymphknoten. Folgende Befunde sind möglich: regrediente Lymphknoten, vergrößerte Lymphknoten ohne Tumormarker und ansteigende Tumormarker bei vergrößerten Lymphknoten:
- Regrediente Lymphknoten werden nicht weiter therapiert, regelhafte Nachsorgen (s. u.) folgen.
- Persistierende oder wachsende Lymphknoten ohne Tumormarkernachweis erfordern eine nervenschonende RLA (s.o.).
- Bei ansteigenden Tumormarkern und vergrößerten Lymphknoten sind drei Zyklen PEB notwendig.
Growing Teratoma Syndrome:
Das "growing teratoma syndrome" ist die Größenzunahme der retroperitonealen Lymphknoten unter PEB-Chemotherapie trotz adäquater Markernormalisierung. Verantwortlich sind wachsende Teratomanteile in den Lymphknotenmetastasen, welche nicht auf eine Chemotherapie ansprechen. Voraussetzung für die Diagnose ist das Vorkommen von Teratomanteilen im Hodentumor. Nach Vollendung der Chemotherapie muss im Anschluss eine RLA mit vollständiger Resektion aller Tumoranteile durchgeführt werden. Die komplexe Operation erfordert häufig die Mitresektion von größeren Gefäße wie Aorta oder Vena cava und sollte mit Gefäßchirurgen geplant werden.
Therapie von Keimzelltumoren Stadium IIC und III
Für die Wahl der Chemotherapie ist die Eingruppierung des Patienten in die Risikogruppen nach IGCCCG wegweisend.
Gute Prognose:
Chemotherapie mit drei Zyklen PEB. Bei Kontraindikation gegen Bleomycin sind 4 Zyklen PE (Cisplatin und Etoposid) möglich.
Mittlere Prognose:
Chemotherapie mit 4 Zyklen PEB. Bei Kontraindikation gegen Bleomycin sind alternativ vier Zyklen PEI (Cisplatin, Etoposid und Ifosfamid) möglich.
Schlechte Prognose:
Chemotherapie mit 4 Zyklen PEB. Bei Kontraindikation gegen Bleomycin sind alternativ 4 Zyklen PEI (Cisplatin, Etoposid und Ifosfamid) möglich. Folgende Risikofaktoren sprechen für eine Intensivierung der Therapie (Hochdosis-Chemotherapie): schlechtes Ansprechen der Tumormarker nach 1–2 Zyklen, Hirnmetastasen, Knochenmetastasen und primär mediastinale Erkrankung. Die genaue Indikation und weitere Subgruppen, welche von der Dosiseskalation profitieren, sind jedoch nicht klar definiert. Nicht nur aus diesem Grunde sollte die Therapie dieser Patientengruppe in speziellen Zentren im Rahmen von Studien durchgeführt werden.
Prinzipien der Chemotherapie bei fortgeschrittenen Hodentumoren
Die Chemotherapie sollte ohne Dosisreduktion und ohne Zeitverzögerung (Zyklusdauer 21 Tage) durchgezogen werden. Fieber, eine Neutropenie unter 500/μl oder eine Thrombozytopenie unter 100 000/μl sind seltene Gründe, die Chemotherapie um maximal drei Tage zu verschieben.
Die prophylaktische Gabe von G-CSF ist nur nach fiebriger Neutropenie gerechtfertigt. Die prophylaktische Gabe von Antibiotika nach fiebriger Neutropenie ist umstritten.
Die Bestimmung der Tumormarker vor Beginn jedes Zyklus ist Pflicht. Nach dem zweiten Zyklus und nach Abschluss der Chemotherapie wird ein Restaging durchgeführt. Bei unzureichendem Ansprechen (Tumormarkerverlauf, Bildgebung) ist eine Hochdosischemotherapie notwendig. Die Therapie dieser Patientengruppe sollte in speziellen Zentren im Rahmen von Studien durchgeführt werden.
Das Erreichen der Bleomycin-Maximaldosis oder bei pulmonalen Nebenwirkungen macht einen Wechsel auf das PEI-Schema notwendig (Cisplatin, Etoposid und Ifosfamid).
Therapie von Hirnmetastasen bei Hodentumoren
Hirnmetastasen haben eine Langzeitheilungschance von 30 %, die Therapie besteht aus 4 Zyklen PEB zusammen bzw. gefolgt von einer Strahlentherapie des Hirns. Hirnmetastasen, welche sich unter oder nach Therapie als Rezidiv manifestieren, haben eine sehr schlechte Prognose mit einer 5JÜR von 2–5 %.
Knochenmetastasen:
Knochenmetastasen gehen mit einer ungünstigen Prognose mit Langzeitheilungsraten von 35–45% einher. Im Anschluss an die Chemotherapie soll eine anschließende Lokaltherapie der Knochenherde erwogen werden (Chirurgie oder Strahlentherapie). Eine primäre Hochdosis-Chemotherapie sollte individuell erwogen werden.
Resttumoren nach Chemotherapie von Hodentumoren
Die operative Entfernung von Residualtumorgewebe (retroperitoneale Lymphadenektomie = RLA) ist eine schwierige Operation mit hoher Morbidität. Ursächlich dafür sind die fibrotischen Veränderungen nach Chemotherapie, welche vitale Leitungsbahnen (Vena cava, Aorta und Ureteren) fest mit dem Residualtumor verbinden und eine Präparation teilweise unmöglich machen. Für ein gutes onkologisches Ergebnis müssen entsprechende Resektionen und Gefäßersatz eingeplant werden. Weiterhin besitzen die Patienten nach mehreren Zyklen Chemotherapie nur eingeschränkte (pulmonale) Reserven. Die Indikationen für eine Post-Chemotherapie RLA unterscheidet sich zwischen Seminom und Nichtseminom. Die Bildgebung hinsichtlich eines Residualtumors sollte erst 8 Wochen nach Ende der Chemotherapie durchgeführt werden.
Retroperitonealer Resttumor nach Seminomtherapie:
Häufig bleibt nach Chemotherapie ein fibrotischer Resttumor zurück, der sich wie Morbus Ormond um die großen Gefäße legt. Resttumoren nach einer Chemotherapie werden mittels Tumormarker und Bildgebung nachgesorgt. Bei großen Resttumoren über 3 cm ist eine PET-Untersuchung sinnvoll. Wenn eine wachsende, stoffwechselaktive Läsion festgestellt wird (ggf. Wiederholung der Bildgebung), sollte eine maximale chirurgische Resektion (wenn möglich) in Erwägung gezogen werden; andere Behandlungsmöglichkeiten sind eine Salvage-Chemotherapie oder eine Strahlentherapie.
Retroperitonealer Resttumor nach Nichtseminomtherapie:
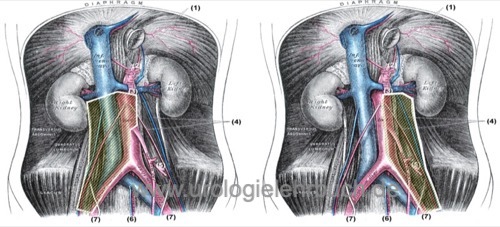
Indiziert ist die RLA bei Resttumoren über 1 cm Größe und bei negativen Tumormarkern. Progrediente Tumormarker sind eine Kontraindikation für eine RLA, eine Salvage-Chemotherapie ist notwendig (s.u.). Die zusätzliche Bildgebung mit z. B. PET ist nicht hilfreich. Ziel ist die Entfernung von chemoresistenten Tumoranteilen (Teratom) und die Festlegung der Notwendigkeit einer weiteren Chemotherapie. Die Grenzen der Lymphadenektomie richten sich nach dem Ausmaß der Metastasierung vor Chemotherapie, das Mindestmaß der Dissektion zeigt Abb. Dissektionsgrenzen der modifizierten rechtsseitigen und linksseitigen retroperitonealen Lymphadenektomie. Die Wahrscheinlichkeit für vitale maligne Resttumoranteile beträgt ungefähr 15 %, in 35 % wird ein Teratom nachgewiesen und in 50 % Nekrosen.
Residualtumoren in der Lunge:
Die Resektion von Tumoren über 1 cm Größe sollte angestrebt werden. Bei bilateralen Residualtumoren soll individuell und nach Vorliegen der Histologie der ersten Resektionsseite entschieden werden.
Salvage-Chemotherapie
Indikationen für eine Salvage-Chemotherapie sind der rezidivierende oder persistierende Keimzelltumor trotz Erstlinientherapie. Folgende Kombinationen werden angewendet: PEI, VeIP (Vinblastin, Ifosfamid und Cisplatin) oder TIP (Paclitaxel, Ifosfamid und Cisplatin).
RLA nach Salvage-Chemotherapie:
es gibt Ansätze einer RLA bei markerpositiven Resttumoren nach Salvage-Chemotherapie, mit einer Ansprechrate von etwa 25 % ("desperation surgery"). Diese Therapie ist eine Option für Patienten mit lokalisierter Erkrankung im Retroperitoneum und moderat erhöhten Tumormarkern ohne schnellen Progress.
Therapie des Spätrezidivs:
ein Spätrezidiv ist definiert als ein Wiederauftreten des Tumors über zwei Jahre nach erfolgreicher Erstlinientherapie. Patienten mit einem Spätrezidiv nach Erstlinien-Chemotherapie haben eine sehr schlechte Prognose. Wenn möglich sollte die Resektion des Tumorrezidivs durchgeführt werden, alternativ wird die Salvage-Chemotherapie in Abhängigkeit von Biopsien des Rezidivs geplant.
Langzeitkomplikationen nach Chemotherapie und Strahlentherapie von Hodentumoren
Insbesondere die Strahlentherapie aber auch die Chemotherapie beherbergen das Risiko für Langzeitkomplikationen, welche dosisabhängig Jahre bis Jahrzehne nach "erfolgreicher" Therapie auftreten können. Es gibt leider keine Langzeitstudien, welche die Nebenwirkungen nach (adjuvanter) Strahlentherapie und Chemotherapie vergleichen (Travis u.a., 2010).
Induktion von Zweittumoren:
Die genauen Häufigkeiten von Zweittumoren nach Chemotherapie oder Strahlentherapie sind unklar. Zweittumoren nach Strahlentherapie treten hauptsächlich in der Nähe des Strahlenfelds auf (Kolon, Pankreas, Magen, Harntrakt), die Erhöhung des relativen Risikos beträgt 2–3. Die Chemotherapie erhöht das Risiko für solide Tumoren und für Leukämien.
kardiovaskuläre Komplikationen:
Chemotherapie erhöht das kardiovaskuläre Risiko durch Endothelschäden und durch die fast doppelt so häufige Ausbildung eines metabolischen Syndroms. Das Risiko der Lungenembolie ist bei Pat. mit fortgeschrittenem Tumorstadium während einer Chemotherapie deutlich erhöht.
Nephrotoxizität:
Kurative cisplatinhaltige Chemotherapie führt zu einer langfristigen Reduktion der GFR von bis zu 30%, dies könnte auch ein Mechanismus für das erhöhte kardiovaskuläre Risiko sein.
Hypogonadismus:
Ohne Chemotherapie ist das Risiko für Hypogonadismus trotz Orchiektomie gering. Nach Chemotherapie entwickeln langfristig 10–30% einen Testosteronmangel, dies erhöht auch das Risiko für das metabolische Syndrom.
Infertilität:
Dosisabhängige langfristige Verschlechterung der Spermienanzahl bis zur Azoospermie. Wenn maximal drei Zyklen PEB verabreicht werden, so erholen sich die Spermiogrammparameter innerhalb von 2 Jahren bei 80% der Pat. (Suzuki u.a., 2013).
Weitere Langzeitkomplikationen:
Chronisches Erschöpfungssyndrom (RR 1,5–2), Ototoxizität mit Hochtonschwerhörigkeit und Tinnitus, Neurotoxizität mit peripherer Polyneuropathie.
Nachsorge der Hodentumoren
Basisnachsorge:
Die Basisnachsorge wird in den beiden ersten Nachsorgejahren alle drei Monate, in den Jahren 3–5 alle sechs Monate und dann jährlich durchgeführt. Bei Patienten nach Bestrahlung oder Chemotherapie endet die Basisnachsorge nicht, bei Patienten mit aktiver Überwachung (Stadium I) kann die Nachsorge nach 10 Jahren beendet werden. Die Basisnachsorge besteht aus:
- Körperliche Untersuchung: Hoden, Abdomen, Palpation der Lymphknotenstationen am Rumpf, Blutdruckmessung und Körpergewicht.
- Tumormarker: Bestimmung von AFP, HCG und LDH, auch wenn diese initial im Normbereich waren.
- Sonographie des kontralateralen Hodens: jährliche Untersuchung.
- Erweitertes Labor: jährliche Bestimmung von Blutfetten, Testosteron, LH und FSH, um einen Hypogonadismus oder metabolisches Syndrom zu erkennen.
Die Bildgebung von Abdomen und Thorax hängt vom Tumorstadium und durchgeführter Therapie ab, es folgen Empfehlungen in Anlehnung an die deutsche S3-Leitlinie und EAU-Leitlinie:
Seminom und Nonseminom Stadium I ohne Chemotherapie:
Die Rezidivgefahr beträgt in Abhängigkeit der Risikofaktoren und Histologie 12–48%, das Rezidiv tritt v.a. im 1.–3. Jahr nach Therapie auf.
- CT- oder MRT-Abdomen: in den Monaten 6, 12, 18 und 24. Die EAU empfiehlt zusätzliche Bildgebung in den Monaten 36 und 60 anstatt Ultraschall Abdomen.
- Ultraschall Abdomen: in den Monaten 30, 36, 48 und 60.
- Rö-Thorax: in den Monaten 6, 12, 18, 24, 30, 36, 48 und 60.
Seminom und Nonseminom Stadium I–IIC mit Chemotherapie oder Strahlentherapie:
Die Rezidivgefahr beträgt in Abhängigkeit Tumorstadium und Histologie 3–18%, das Rezidiv tritt v.a. im 1.–3. Jahr nach Therapie auf.
- CT- oder MRT-Abdomen: in den Monaten 12 und 24. Die EAU empfiehlt zusätzliche Bildgebung in den Monaten 6, 36 und 60 anstatt Ultraschall Abdomen.
- Ultraschall Abdomen: in den Monaten 6, 18, 36, 48 und 60.
- Rö-Thorax: in den Monaten 6, 12, 18, 24, 30, 36, 48 und 60.
Seminom oder Nichtseminom mit Stadium III nach Chemotherapie mit guter Prognose:
Das Rezidivrisiko beträgt bis zu 18%.
- CT- oder MRT-Abdomen: in den Monaten 6, 12 und 24. Die EAU empfiehlt zusätzliche Schnittbildgebung in den Monaten 36 und 60 anstatt Ultraschall Abdomen.
- Ultraschall Abdomen: in den Monaten 18, 36, 48 und 60.
- CT-Thorax: in den Monaten 6, 12, 24 und 60.
Metastasierte Tumoren mit mittlerer oder schlechter Prognose:
Individuell abgestimmte Nachsorge in Abhängigkeit von Ansprechen und Verlauf, als Minimum siehe auch Empfehlung für die Nachsorge Stadium III.
| Hodentumoren | Suchen | extragonadale Tumoren |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Albers, P.; Albrecht, W.; Algaba, F.; Bokemeyer,
C.; Cohn-Cedermark, G.; Fizazi, K.; Horwich, A.; Laguna, M.; Nicolai, N. &
Oldenburg, J.
EAU Guidelines: Testicular Cancer
. https://uroweb.org/guidelines/testicular-cancer/
DGU, DKG, AWMF, and L. Onkologie, “S3-Leitlinie Diagnostik, Therapie und Nachsorge der Keimzelltumoren des Hodens. Langversion 1.1.” [Online]. Available: https://www.leitlinienprogramm-onkologie.de/leitlinien/hodentumoren/
A. Stephenson, E. B. Bass, and B. R. Bixler, “Diagnosis and Treatment of Early-Stage Testicular Cancer: AUA Guideline.” [Online]. Available: https://www.auanet.org/guidelines-and-quality/guidelines/testicular-cancer-guideline
Hartmann, M.; Krege, S.; Souchon, R.; Santis, M. D.;
Gillessen, S.; Cathomas, R. & Hodentumore, I. A.
[Follow-up of
testicular germ cell cancer patients: interdisciplinary evidence-based
recommendations].
Urologe A, 2011, 50, 830-835.
H. W. Herr, J. Sheinfeld, H. S. Puc, R. Heelan, D. F. Bajorin, P. Mencel, G. J.
Bosl, and R. J. Motzer.
Surgery for a post-chemotherapy residual mass in seminoma.
J Urol, 157 (3): 860–862, Mar 1997.
S. Krege, J. Beyer, R. Souchon, P. Albers, and EGCCCG-Members.
European consensus conference on diagnosis and treatment of germ cell
cancer: a report of the second meeting of the european germ cell cancer
consensus group (egcccg): part i.
Eur Urol, 53 (3): 478–496, Mar
2008a.
S. Krege, J. Beyer, R. Souchon, P. Albers, and EGCCCG-Members.
European consensus conference on diagnosis and treatment of germ cell
cancer: a report of the second meeting of the european germ cell cancer
consensus group (egcccg): part ii.
Eur Urol, 53 (3): 497–513, Mar
2008b.
Oliver, R. T. D.; Mead, G. M.; Rustin, G. J. S.; Joffe,
J. K.; Aass, N.; Coleman, R.; Gabe, R.; Pollock, P. & Stenning, S. P.
Randomized
trial of carboplatin versus radiotherapy for stage I seminoma: mature
results on relapse and contralateral testis cancer rates in MRC TE19/EORTC
30982 study (ISRCTN27163214).
J Clin Oncol, 2011, 29,
957-962.
Tandstad, T.; Ståhl, O.; Dahl, O.; Haugnes, H. S.;
Håkansson, U.; Karlsdottir, Å.; Kjellman, A.; Langberg, C. W.; Laurell,
A.; Oldenburg, J.; Solberg, A.; Söderström, K.; Stierner, U.;
Cavallin-Ståhl, E.; Wahlqvist, R.; Wall, N.; Cohn-Cedermark, G. & SWENOTECA
Treatment
of stage I seminoma, with one course of adjuvant carboplatin or
surveillance, risk-adapted recommendations implementing patient autonomy:
a report from the Swedish and Norwegian Testicular Cancer Group
(SWENOTECA).
Annals of oncology, 2016, 27,
1299-1304
Rustin, G. J.; Mead, G. M.; Stenning, S. P.; Vasey, P.
A.; Aass, N.; Huddart, R. A.; Sokal, M. P.; Joffe, J. K.; Harland, S. J.;
Kirk, S. J.
Randomized trial of
two or five computed tomography scans in the surveillance of patients with
stage I nonseminomatous germ cell tumors of the testis: Medical Research
Council Trial TE08, ISRCTN56475197--the National Cancer Research Institute
Testis Cancer Clinical Studies Group.
J Clin Oncol, 2007,
25, 1310-1315.
 English Version: Treatment of testicular cancer: Seminoma and Treatment of testicular cancer: Nonseminoma
English Version: Treatment of testicular cancer: Seminoma and Treatment of testicular cancer: Nonseminoma
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.