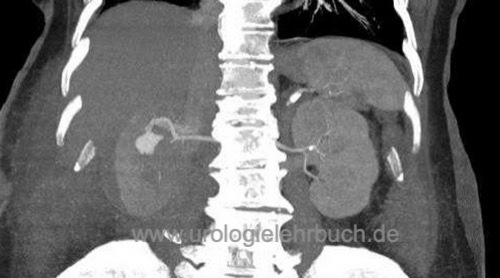
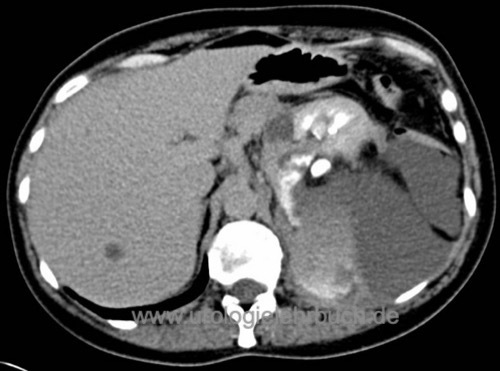
Sie sind hier: Startseite > Nieren > Operationen > Nierenteilresektion
Offen-chirurgische Nierenteilresektion: Technik und Komplikationen
Die offen-chirurgische Nierenteilresektion ist die Standardtechnik für organerhaltende Resektion von Nierentumoren (wie dem Nierenzellkarzinom). Minimalinvasive Alternativen sind die (roboter-assistierte) laparoskopische oder retroperitoneoskopische Nierenteilresektion (Novick, 2002).
Indikationen zur Nierenteilresektion
Imperative Indikationen:
Falls technisch möglich: Nierentumoren bei Einzelniere, bei bilateralen Tumoren, bei Niereninsuffizienz, bei hereditärem Nierenzellkarzinom.
Elektive Indikationen:
Die S3-Leitlinie gibt der Nierenteilresektion bei lokalisiertem Nierenzellkarzinom eindeutig den Vorzug. Falls technisch möglich, soll bei T1-Tumoren und sollte bei T2-Tumoren eine Nierenteilresektion anstatt einer Tumornephrektomie durchgeführt werden. Retrospektive Vergleiche zwischen Tumornephrektomie und Nierenteilresektion bei T1-Tumoren zeigten eine bessere Prognose für die Nierenteilresektion. Dies wird mit einer Reduktion kardiovaskulärer Erkrankungen durch die bessere Nierenfunktion erklärt (Zini, 2009) (Weight, 2010). Die randomisierte EORTC-Studie (Tumornephrektomie vs. Nierenteilresektion) konnte diesen Effekt nicht nachweisen (Van Poppel u.a., 2011).
Benigne Erkrankungen:
Große Angiomyolipome, Kelchdivertikel, Doppelanlage mit funktionslosem (oberem) Anteil oder Echinokokkuszysten.
Kontraindikationen
Gerinnungsstörungen. Weitere Kontraindikationen sind abhängig von dem Operationsrisiko und der Bedeutung der Nierenteilresektion für die Lebensqualität oder Lebenserwartung des Patienten.
Technik der Nierenteilresektion
Patientenvorbereitung:
Perioperative Antibiotikaprophylaxe. Perioperativer Dauerkatheter und Magensonde. Periduralanästhesie wenn möglich und gewünscht. Manche Autoren bevorzugen die Einlage einer DJ- oder MJ-Harnleiterschiene bei geplanter großer Eröffnung des Nierenbeckenkelchsystems.
Operativer Zugang:
In den meisten Fällen wird der retroperitoneale Flankenschnitt verwendet, aber je nach Lage des Tumors ist auch ein transperitonealer ventraler Zugang (Rippenbogenrandschnitt) möglich. Aufsuchen des Harnleiters (anzügeln), von dort wird entlang der Vena cava (rechts) oder Aorta (links) nach kranial der Nierenhilus aufgesucht. Präparation der A. renalis und V. renalis, die Hilusgefäße werden Gefäßschlingen angezügelt.
Renale Ischämie:
Kleinere Tumoren werden ohne Ischämie abgetrennt. Bei größeren Tumoren ist die Präparation unter Ischämie sinnvoll. Die tolerierbare warme Ischämiezeit für die Niere ist je nach Autor unterschiedlich, sollte aber 30 min nicht überschreiten. Für eine Ischämie sind mehrere Techniken möglich: Bulldog-Klemme, Gefäßzügel (Rummel Tourniquet) oder Satinsky-Klemme zur Okklusion der Hilusgefäße. Der ischämische Schaden soll bei selektivem Abklemmen der A. renalis geringer sein. Bei der kalten Ischämie wird vor der Nierenteilresektion die abgeklemmte Niere mit Eiswasser gekühlt, die Ischämiezeit kann dadurch deutlich verlängert werden.
Die Gabe eines osmotischen Diuretikums wie Mannitol vor (und nach) dem Abklemmen der Nierengefäße soll den Reperfusionsschaden nach renaler Ischämie senken. Als Mechanismus werden die Steigerung der Diurese und antioxidative Eigenschaften von Mannitol angegeben. Die Dosierung beträgt meist 25 g Mannitol. Trotz breiter Anwendung von Diuretika im Rahmen der Nierenteilresektion gibt es für diese Praxis keine belastbaren Daten (Cosentino u.a., 2012) (Power u.a., 2012).
Nierenteilresektion:
Je nach Lage und Größe des Tumors werden Tumorenukleationen, Keilexzisionen, Polamputationen oder in seltenen Fällen ex vivo Präparationen mit Autotransplantation durchgeführt. Ein Sicherheitsabstand zum Tumor ist nicht erforderlich, die Enukleation des Tumors in seiner Pseudokapsel ist statthaft (Minervini u.a., 2012). Wichtig ist ein makroskopisch tumorfreier Absetzungsrand, eine Schnellschnittuntersuchung bietet keine zusätzliche Sicherheit und wird nur im Zweifel mit Markierung der suspekten Stelle angeraten (Dagenais u.a., 2018).
Die Entfernung des Tumors ohne Ischämie wird mit Koagulation (monopolar, bipolar) oder Ultraschall-Messer durchgeführt. Bei der Präparation mit Ischämie ermöglicht die scharfe und stumpfe Präparation ohne Koagulation eine bessere Visualisierung der Schichten. Sichtbare Blutungsquellen werden umstochen oder mit Clips versorgt. Das eventuell eröffnete Hohlsystem wird fortlaufend verschlossen. Nach Freigabe der Ischämie können gezielt Blutungen umstochen werden. Anschließend wird der Parenchymdefekt mit tief durchgreifenden Parenchymnähten geschlossen. Durch die fortlaufende Parenchymnaht entsteht eine gute Hämostase. Hämostyptika (Markenprodukte wie Floseal, Tachosil, Surgiflo...) können die Hämostase unterstützen, durchgreifende Nähte überflüssig machen und die Operation vereinfachen Technik der Nierenteilresektion.
Lymphadenektomie bei der Nierenteilresektion:
Bei Tumoren mit T1–2 cN0 sollte keine Lymphadenektomie durchgeführt werden, da in einer großen EORTC-Studie kein Überlebensvorteil demonstriert werden konnte (Blom u.a., 1999 und 2009). Vergrößerte Lymphknoten werden durch eine limitierte regionale Lymphadenektomie entfernt.
Drainage:
Die Drainage der Nierenloge nach einer Nierenteilresektion ist sinnvoll.
Harnableitung:
Manche Autoren bevorzugen die Einlage einer DJ-Harnleiterschiene oder MJ-Harnleiterschiene bei großer Eröffnung des Nierenbeckenkelchsystems. Dies ist möglich vor der Operation, über das eröffnete Hohlsystem oder über eine Pyelostomie nach Verschluss des Nierenparenchymdefekts. Zusätzlich sollte für eine druckfreie Harnableitung ein transurethraler DK belassen werden, bis die Wunddrainage entfernt werden kann.
Nachsorge nach Nierenteilresektion
Allgemeine Maßnahmen:
Frühzeitige Mobilisation. Atemtherapie. Thromboseprophylaxe. Laborkontrollen (Hb, Kreatinin). Wundkontrollen und regelmäßige Untersuchung des Abdomens.
Analgesie:
Idealerweise über einen Epiduralkatheter. Schmerztherapie mit einer Kombination aus Nichtopioid-Analgetika und Opioid.
Kostaufbau:
Entfernung der Magensonde nach der Operation. Schluckweise Tee und klare Brühe am ersten postoperation Tag, dann Kostaufbau.
Drainagen und Katheter:
Eine rasche Entfernung des Blasenkatheters nach unkomplizierter Operation ist möglich bei stabilen Patienten ohne Ureterstent innerhalb von 1--2 Tagen. Die Wunddrainage wird entfernt, wenn das tägliche Drainagevolumen deutlich unter 50 ml liegt. Patienten mit Ureterstents benötigen einen Blasenkatheter, bis die Entfernung der Wunddrainage möglich ist.
Komplikationen nach Nierenteilresektion
In der Tab. 1.1 werden vergleichend die Komplikationen zwischen Tumornephrektomie und Nierenteilresektion aus randomisierten und retrospektiven Studien dargestellt.
| Komplikationen | Tumornephrektomie | Nierenteilresektion |
| Schwere Blutungen | 1,1 % | 3,4 % |
| Blutverlust <0,5 l | 96 % | 87 % |
| Urinom | 0 % | 4 % |
| Reintervention | 2,4 % | 4,4 % |
| Mortalität | 2 % | 1,6 % |
Blutungsrisiko:
Das Risiko eines Blutverlustes über 500 ml liegt bei der Nierenteilresektion bei 13 %. Postoperative Blutungen werden durch die radiologische Embolisation i.d.R. erfolgreich versorgt. Nachblutungen können jedoch selten die operative Revision mit Nephrektomie erzwingen. Eine seltene Ursache für eine zweizeitige Blutungskomplikation ist die Ausbildung eines Aneurysma spurium [Aneurysma spurium nach Nierenteilresektion].
Urinextravasation:
Die meisten Urinfisteln verschließen sich durch eine adäquate Nierenlogendrainage und Einlage eines Ureterkatheters ohne weitere Maßnahmen [Urinom nach Nierenteilresektion].
Harnstau:
Harnstau entsteht durch Hämaturie mit Koagelbildung.
Niereninsuffizienz:
Eine akute Niereninsuffizienz entsteht durch die Ischämie einer Einzelniere, es besteht auch die Gefahr einer terminalen Niereninsuffizienz. Je nach zuvorbestehender chronischer Niereninsuffizienz droht im Verlauf eine Hyperfiltrations-Nephropathie, wenn mehr als 50 % der Nephrone entfernt werden. Frühzeichen sind eine Proteinurie und ansteigende Kreatininwerte. Die Therapie besteht in einer diätischen Proteinreduktion und der Gabe von ACE-Hemmern.
Nachbarorganverletzung:
Leberrisse, Milzverletzung (Splenektomie), paralytischer Ileus, Darmverletzung, Peritonitis, Pankreasschwanzverletzung mit Ausbildung einer Pankreasfistel, Pneumothorax bei lumbalem oder thorakoabdominalem Zugang, Chylusfistel durch Verletzung der Darmlymphgefäße.
Allgemeine Komplikationen:
Wundinfektion, Herzinfarkt, Schlaganfall, Herzinsuffizienz, Thrombose, Lungenembolie, Atelektasen, Pneumonie, akutes Nierenversagen.
Mortalität:
Durch Blutungen, Infektionen, Arrhythmien, akutes Nierenversagen, Lungenembolie in 2%.
Nierenteilresektion in Augsburg
Sie wünschen die Nierenteilresektion in Augsburg beim Autor dieser Seite? Vereinbaren Sie einen Termin bei Dr. Manski in der Urologischen Gemeinschaftspraxis, Gögginger Str. 49 in Augsburg unter der Telefonnummer 0821 512200. Weitere Informationen zu Dr. Manski siehe Urologische Gemeinschaftspraxis Augsburg.
| Tumornephrektomie | Suchen | Lap. Nierenteilresektion |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Blom, Jan H M; van Poppel, Hein; Maréchal, Jean M;
Jacqmin, Didier; Schröder, Fritz H; de Prijck, Linda; Sylvester, Richard &
E. O. R. T. C. Genitourinary Tract Cancer Group
Radical nephrectomy
with and without lymph-node dissection: final results of European
Organization for Research and Treatment of Cancer (EORTC) randomized phase
3 trial 30881.
Eur Urol, 2009, 55, 28-34.
Corman u.a. 2000 CORMAN, J. M. ; PENSON,
D. F. ; HUR, K. ; KHURI, S. F. ; DALEY, J. ;
HENDERSON, W. ; KRIEGER, J. N.:
Comparison of complications after radical and partial nephrectomy:
results from the National Veterans Administration Surgical Quality
Improvement Program.
In: BJU Int
86 (2000), Nov, Nr. 7, S. 782–789
Cosentino, M.; Breda, A.; Sanguedolce, F.; Landman, J.;
Stolzenburg, J.; Verze, P.; Rassweiler, J.; Poppel, H. V.; Klingler, H.
C.; Janetschek, G.; Celia, A.; Kim, F. J.; Thalmann, G.; Nagele, U.;
Mogorovich, A.; Bolenz, C.; Knoll, T.; Porpiglia, F.; Alvarez-Maestro, M.;
Francesca, F.; Deho, F.; Eggener, S.; Abbou, C.; Meng, M. V.; Aron, M.;
Laguna, P.; Mladenov, D.; D'Addessi, A.; Bove, P.; Schiavina, R.; Cobelli,
O. D.; Merseburger, A. S.; Dalpiaz, O.; D'Ancona, F. C. H.; Polascik, T.
J.; Muschter, R.; Leppert, T. J. & Villavicencio, H.
The use of
mannitol in partial and live donor nephrectomy: an international survey.
World
J Urol, 2012.
DGU Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms, Langversion 1.02015. http://leitlinienprogramm-onkologie.de/Nierenzellkarzinom.85.0.html
J. Dagenais et al., “Frozen Sections for Margins During Partial Nephrectomy Do Not Influence Recurrence Rates.,” J Endourol., vol. 32, no. 8, pp. 759–764, 2018, doi: 10.1089/end.2018.0314.
Minervini, A.; Serni, S.; Tuccio, A.; Siena, G.;
Vittori, G.; Masieri, L.; Giancane, S.; Lanciotti, M.; Khorrami, S.;
Lapini, A. & Carini, M.
Simple enucleation versus radical
nephrectomy in the treatment of pT1a and pT1b renal cell carcinoma.
Ann
Surg Oncol, 2012, 19, 694-700.
Novick 2002 NOVICK, A. C.:
Nephron-sparing surgery for renal cell carcinoma.
In: Annu Rev Med
53 (2002), S. 393–407
Poppel u.a. 2007 POPPEL, Hendrik V. ; POZZO,
Luigi D. ; ALBRECHT, Walter ; MATVEEV, Vsevolod ;
BONO, Aldo ; BORKOWSKI, Andrzej ; MARECHAL,
Jean-Marie ; KLOTZ, Laurence ; SKINNER, Eila ;
KEANE, Thomas ; CLAESSENS, Ilse ; SYLVESTER,
Richard ; RESEARCH for the European Organization for ;
CANCER (EORTC), Treatment of ; CANADA CLINICAL TRIALS GROUP
(NCIC CTG), National Cancer I. of ; (SWOG), Southwest Oncology G. ;
EASTERN COOPERATIVE ONCOLOGY GROUP (ECOG) the:
A prospective randomized EORTC intergroup phase 3 study comparing the
complications of elective nephron-sparing surgery and radical nephrectomy for
low-stage renal cell carcinoma.
In: Eur Urol
51 (2007), Jun, Nr. 6, S. 1606–1615
Poppel, H. V.; Pozzo, L. D.; Albrecht, W.; Matveev, V.;
Bono, A.; Borkowski, A.; Colombel, M.; Klotz, L.; Skinner, E.; Keane, T.;
Marreaud, S.; Collette, S. & Sylvester, R.
A prospective,
randomised EORTC intergroup phase 3 study comparing the oncologic outcome
of elective nephron-sparing surgery and radical nephrectomy for low-stage
renal cell carcinoma.
Eur Urol, 2011, 59, 543-552.
Power, N. E.; Maschino, A. C.; Savage, C.; Silberstein,
J. L.; Thorner, D.; Tarin, T.; Wong, A.; Touijer, K. A.; Russo, P. &
Coleman, J. A.
Intraoperative mannitol use does not improve long-term
renal function outcomes after minimally invasive partial nephrectomy.
Urology,
2012, 79, 821-825.
Weight, C. J.; Larson, B. T.; Fergany, A. F.; Gao, T.; Lane, B. R.; Campbell, S. C.; Kaouk, J. H.; Klein, E. A. & Novick, A. C.
Nephrectomy induced chronic renal insufficiency is associated with increased risk of cardiovascular death and death from any cause in patients with localized
cT1b renal masses.
J Urol, 2010, 183, 1317-1323
Zini, L.; Perrotte, P.; Capitanio, U.; Jeldres, C.; Shariat, S. F.; Antebi, E.; Saad, F.; Patard, J.; Montorsi, F. &
Karakiewicz, P. I.
Radical versus partial nephrectomy: effect on
overall and noncancer mortality.
Cancer, 2009, 115,
1465-1471
 English Version: Radical nephrectomy
English Version: Radical nephrectomy
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.