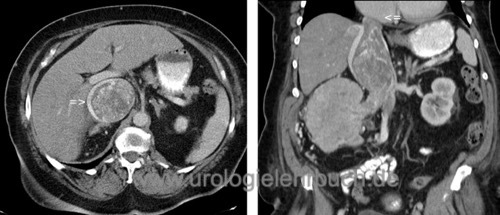
Sie sind hier: Startseite > Nieren > Nierenzellkarzinom > Ursachen
Nierenzellkarzinom: Ursachen und TNM-Stadien
- Nierenzellkarzinom: Ursachen und Pathologie
- Nierenzellkarzinom: Klinik und Diagnose
- Nierenzellkarzinom: operative Therapie
- Nierenzellkarzinom: Therapie des metastasierten Nierenzellkarzinoms
Definition des Nierenzellkarzinoms
Das Nierenzellkarzinom ist mit 90% der häufigste bösartige Tumor der Niere und geht vom Epithel verschiedener Nephronabschnitte aus. Synonyme: Nierenkrebs, Nierenkarzinom. EAU Guidelines. Deutsche S3-Leitlinie Nierenzellkarzinom.
 |
Epidemiologie
Krebsstatistik:
- Das Nierenzellkarzinom stellt 3 % aller Tumorerkrankungen
- Dritthäufigste maligne urologische Tumorerkrankung, Position 10 in der Krebsstatistik der EU 2008.
- Die Häufigkeit des Nierenzellkarzinoms war in den letzten Dekaden steigend und stabilisiert sich nun europaweit.
Mortalität des Nierenzellkarzinoms:
Im Trend sinkend, die standardisierte Sterberate in Deutschland betrug 2018 in Deutschland 5/100000 für Männer und 2/100000 für Frauen (RKI, 2021).
Inzidenz:
Standardisierte Neuerkrankungsrate 2018 in Deutschland:: 15/100000 für Männer und 8/100000 für Frauen (RKI, 2021) .
Erkrankungsgipfel:
steigende Inzidenz mit dem Lebensalter (Gipfel bei 70–75 Lebensjahre). Das Nierenzellkarzinom kann aber auch bei Kindern vorkommen.
Tumorstadium:
Die meisten Nierentumoren bei Erstdiagnose sind lokal begrenzt (Stadium T1 und T2), fortgeschrittene T4-Tumoren haben nur einen geringen Anteil von 2%.
Ursachen (Ätiologie und Pathogenese)
Tumorentstehung
Ursprung:
des klarzelligen Nierenzellkarzinoms ist der proximale Tubulus, andere histologische Typen entstehen von distaleren Nephronabschnitten.
Karzinogene Substanzen:
Rauchen (RR 1,4–2,3 dosisabhängig), Kautabak, Cadmium, Blei, petrochemische Substanzen, Lösungsmittel, Thorotrast, Teer und Holzschutzmittel. Das Nierenzellkarzinom ist selten eine anerkannte Berufserkrankung (BK 1302) nach ausgeprägter Exposition mit dem Lösungsmittel Trichlorethylen (TRI).
Epidemiologische Risikofaktoren für ein Nierenzellkarzinom:
terminale Niereninsuffizenz (RR 3–6), Adipositas (RR 2,7), arterieller Hypertonus, niedriger sozialer Status, urbane Herkunft, Rauchen (RR 1,4–2,3), erhöhter Konsum von Fetten und Proteinen mit der Nahrung. Moderater Alkoholkonsum oder viel Sport sind protektiv.
Molekularbiologie:
bei der Mehrzahl der sporadischen Nierenzellkarzinome sind Mutationen des VHL Gens nachweisbar (s. u.).
Familiäres Nierenzellkarzinom
Das Risiko für ein Nierenzellkarzinom für erstgradige Verwandte von betroffenen Patienten ist etwa verdoppelt, dies spricht für eine hereditäre Komponente. Mehrere Genvariationen für ein erhöhtes Risiko (mit niedriger Penetranz) sind bekannt, z.B. Variationen des HIF 2 alpha (hypoxia-inducible factor). Etwa 5–8% aller Nierenzellkarzinome werden vererbt. Unten genannte seltene genetische Syndrome folgen meist einer autosomal-dominanten Vererbung (Verine u.a., 2010).
von Hippel-Lindau-Krankheit und Nierenzellkarzinom:
Autosomal dominante Vererbung mit hohem Risiko für ein klarzelliges Nierenzellkarzinom, ausführliche Darstellung siehe Von-Hippel-Lindau-Syndrom . Das VHL-Protein ist ein Tumorsuppressorprotein und liegt auf Chromosom 3. Die Tumoren entstehen gemäß der Knudson-Theorie der zwei Treffer: ein erkranktes Gen wird vererbt, die zweite Veränderung entsteht durch eine spontane Mutation. Tumoren entstehen nur, wenn beide VHL-Gene mutiert sind. Die Wahrscheinlichkeit für ein Auftreten des Nierenzellkarzinoms (klarzellig) bei Hippel-Lindau Patienten beträgt 25–70 %. Die Tumoren treten bei diesen Patienten früher, multifokal und kombiniert mit Veränderungen in anderen Organen auf (ZNS, Retina, Nebennieren, zystische Veränderungen in den parenchymatösen Organen).
Hereditäres papilläres Nierenzellkarzinom (HPRCC):
Das hereditäre papilläre Nierenzellkarzinom (HPRCC) wird autosomal dominant vererbt und führt zu papillären Nierenzellkarzinomen (basophil papilläre Histologie, Typ 1). Mutationen im MET Protoonkogen sind auf Chromosom 7 beschrieben worden, MET kodiert den Hepatozytenwachstumsfaktorrezeptor (HGFR). Bis auf das papilläre Nierenzellkarzinom sind andere Tumorentitäten bei HPRCC nicht gehäuft. Eine genetische Diagnostik ist möglich.
Tuberöse Sklerose:
Erhöhtes Risiko eines Nierenzellkarzinoms [siehe Abschnitt Tuberöse Sklerose].
Birt-Hogg-Dubé-Syndrom:
Benigne Hauttumoren (Fibrofollikulome), renale Tumoren (chromophobes Nierenzellkarzinom, Onkozytome, seltener klarzelliges Nierenzellkarzinom) und pulmonale Zysten mit Gefahr des Spontanpneumothorax. Etwa 25% der Patienten entwickeln Nierentumoren. Das verantwortliche Gen (FLCN) kodiert ein Protein (Folliculin) mit Tumorsuppressorfunktion. Der Gendefekt wird autosomal dominant vererbt, genetische Diagnostik ist möglich (Menko u.a.,2009). Etwa 25% der Genträger entwickeln Nierentumoren.
Hereditäre Leiomyomatose und Nierenzellkarzinom-Syndrom:
Das 2001 beschriebene Syndrom mit cutanen und uterinen Leiomyomen führt zu besonders aggressiven Nierenzellkarzinomen, in der Histologie entweder Typ 2 papilläres Nierenzellkarzinom oder Sammelrohrkarzinom. Das HLRCC-Syndrom (engl. für hereditary leiomyomatosis and renal cell cancer) entsteht durch Mutationen des Fumarathydratase-Gens (FH) und wird autosomal dominant vererbt (Badeloe u.a., 2009). Eine genetische Diagnostik ist möglich. Die genaue Verbindung zwischen dem Enzym des Citratzyklus und dem Nierenzellkarzinom ist noch unklar. Anders als bei o.g. familiären Syndromen sollten Nierentumoren bei dem HLRCC-Syndrom sofort operativ therapiert werden, da sie frühzeitig metastasieren.
Tumorbiologie
Immunbiologie:
Das Nierenzellkarzinom induziert eine deutliche immunologische Reaktion, mehrere immunologische Mechanismen konnten inzwischen in der Therapie erfolgreich angewendet werden:
Spontane Regression:
Die spontane Regression von Metastasen des Nierenzellkarzinoms nach zytoreduktiver Tumornephrektomie (in 1–7%) wird durch immunologische Faktoren erklärt. Die Remission kann über einen langen Zeitraum stabil sein.
Interferon und Interleukin:
Die Immuntherapie mit Interferon und Interleukin führt zu einer Ansprechrate von 10–20%.
Immuncheckpoints:
Die Aktivierung von Immuncheckpoint Rezeptoren führt zur Hemmung und Schwächung der zellulären Immunreaktion. Sie haben ihre physiologische Funktion in der Vermeidung von Autoimmunerkrankungen. Verschiedene Rezeptoren wurden identifiziert: PD-1-Rezeptor (PD für programmed cell death) oder CTLA-4 (CTLA für cytotoxic T lymphocyte antigen) auf T-Lymphozyten mit entsprechende Liganden wie PD-L1. Tumoren nutzen o.g. Wege um eine Immuntoleranz zu induzieren. Die Hemmung der Immuncheckpoints mit spezifischen Antikörpern führt zu einem deutlichen Ansprechen und Verbesserung des Überlebens beim fortgeschrittenen Nierenzellkarzinom.
Regulation der Proliferation und Tumorvaskularisation:
Die reiche Neovaskularisierung wird ausgelöst durch die Überexpression von VEGF. Proliferation durch erhöhte Expression von TGF-α, EGF-Rezeptoren, Hochregulation der Ras-Raf-MAPK-Signaltransduktion, erhöhte Expression von MET Protoonkogen (Rezeptortyrosinkinase für den Hepatozytenwachstumsfaktor), Aktivierung von mTOR (mammalian Target of Rapamycin), einem zentralen Molekül der intrazellulären Signaltransduktion von Zellwachstum, Angiogenese, Energiehaushalt und Apoptose. Die Regulation von Proliferation und Vaskularisation können mit Hemmern der Signaltransduktion beeinflusst und damit die Prognose von Patienten verbessert werden.
Regulation der Zelladhäsion:
Veränderte intrazelluläre Verarbeitung von Fibronectin, erhöhte Expression von Proteasen wie Plasmin und der Matrix Metalloproteinasen, verminderte Expression von E-Cadherin und Cadherin-6.
Resistenz gegenüber der Chemotherapie:
Die Expression von multidrug resistance protein-1 (MDR-1) wird für die fehlende Sensitivität gegenüber der Chemotherapie verantwortlich gemacht. MDR-1 (P-Glykoprotein) ist ein transmembranäres Protein, welches hydrophobe Substanzen aus der Zelle schleust.
Pathologie
Tumorstadien des Nierenzellkarzinoms nach TNM [UICC 2017]
T1:
Tumor begrenzt auf die Niere, kleiner als 7 cm.- T1a: Tumor kleiner als 4 cm.
- T1b: Tumor 4 cm bis 7 cm groß.
T2:
Tumor begrenzt auf die Niere, größer als 7 cm.- T2a: Tumor 7 cm bis 10 cm groß.
- T2b: Tumor über 10 cm groß.
T3:
Tumor infiltriert das perirenale Fettgewebe, das Nierenbeckenkelchsystem oder breitet sich in größeren Venen aus, noch begrenzt innerhalb der Fascia renalis.
- T3a: Tumorausdehnung in die Nierenvene, deren segmentalen Äste oder Infiltration von perirenalem Fettgewebe oder Infiltration des Nierenbeckenkelchsystems.
- T3b: Tumorausdehnung in Vena cava unterhalb des Zwerchfells.
- T3c: Tumorausdehnung in Vena cava oberhalb des Zwerchfells oder Befall der Venenwand.
T4:
Infiltration über die Fascia renalis hinaus, einschließlich zusammenhängender Ausdehnung in die ipsilaterale Nebenniere.
N:
Lymphknotenbefall.- N0: keine Lymphknotenmetastasen.
- N1: Metastase(n) in einem oder mehreren regionalen Lymphknoten.
M:
Fernmetastasen.- M0: keine Fernmetastasen.
- M1: Fernmetastasen.
G:
Grading- G1: gut differenziert
- G2: mäßig differenziert
- G3: schlecht differenziert
- G4: undifferenziert
Tumorstadien des Nierenzellkarzinoms nach UICC
- Stadium I: T1 N0 M0
- Stadium II: T2 N0 M0
- Stadium III: T3 N0 M0 oder T1--T3 N1 M0
- Stadium IV: T4 N0--1 M0 oder T1--4 N0--1 M1
Makroskopische Pathologie
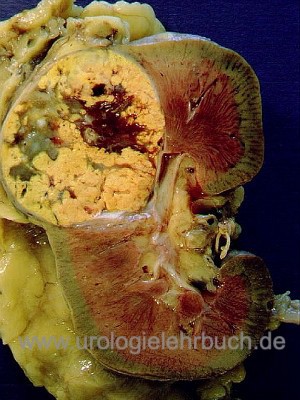
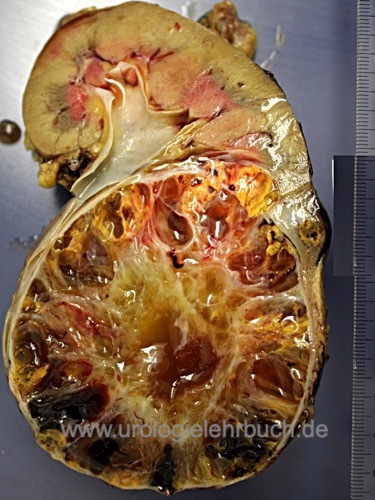
Das klassische Nierenzellkarzinom hat eine gelb-braune Schnittfläche, inhomogen durch Einblutungen und Nekrosen [Abb. Operationspräparat Niere mit Nierenzellkarzinom]. Makroskopisch ist es relativ gut vom Nierengewebe abgetrennt, nur bei sarkomatoiden Tumoren kommt es zu einem infiltrierenden Wachstum. Es besteht aber die Neigung zur Ausbildung von Tumorsatelliten. Weitere Formen beinhalten ein zystisches Wachstumsmuster [multilokuläres zystisches Nierenzellkarzinom und zystisches Nierenzellkarzinom]. Verkalkungen findet man in 10–20 %. Eine Invasion der Nierenvene entsteht in 10 %, durch kontinuierliches Wachstum entsteht ein Tumorzapfen, der bis in den rechten Vorhof reichen kann [Abb. großer Cavathrombus].
 |
Mikroskopische Pathologie des Nierenzellkarzinoms
Histologische Einteilung des Nierenzellkarzinoms nach WHO 2016:
Die aktuelle Klassifikation des Nierenzellkarzinoms berücksichtigt morphologische, genetische und prognostische Unterschiede (Moch u.a., 2016). Da die Subtypen teilweise eine unterschiedliche molekularbiologische Karzinogenese besitzen, sind Unterschiede im therapeutischen Ansprechen auf Inhibitoren der Signaltransduktion ebenfalls zu erwarten (Algaba u.a., 2011).
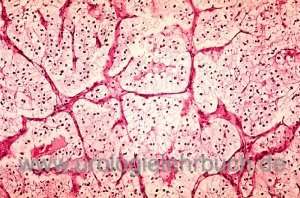
Klarzelliges Nierenzellkarzinom (70–80 %):
Das klarzellige Nierenzellkarzinom besitzt makroskopisch eine gelb-braune Schnittfläche, durch reichhaltiges Glykogen und Fette im Zytoplasma erhalten die Zellen ein klares Aussehen in konventionellen Färbemethoden [Abb. Histologie Nierenzellkarzinom]. Der Tumor entsteht aus dem proximalen Tubulus und ist reichlich vaskularisiert. Es gibt aber auch granularzellartige (eosinophile), sarkomatoide (1–5 %) und gemischte Differenzierungsmuster. In 75 % sind VHL Mutationen nachweisbar.
 |
Papilläres Nierenzellkarzinom (10 %):
Das papilläre Nierenzellkarzinom besitzt basophile (Typ 1) oder eosinophile (Typ 2) Zellen, welche papilläre oder tubuläre Muster bilden. Der Tumor entsteht aus dem proximalen Tubulus und ist gering vaskularisiert. Die Prognose ist im Vergleich zum klarzelligen Nierenzellkarzinom besser, wenn der Tumor lokalisiert ist. Im metastasierten Stadium ist die Prognose aber schlechter (Steffens u.a., 2012).
Chromophobzelliges Nierenzellkarzinom (5 %):
Das chromophobzellige Nierenzellkarzinom stammt vom kortikalen Anteil des Sammelrohrs ab. Das fehlende Anfärben des Zytoplasmas in der Färbung der großen polygonalen Zellen war namensgebend. Im Elektronenmikroskop finden sich zahlreiche Mikrovesikel, welche ein Mukopolysaccharid enthalten. Wahrscheinlich ist das chromophobzellige Nierenzellkarzinom die maligne Variante des Onkozytoms. Die Prognose ist besser als bei dem klarzelligen Nierenzellkarzinom.
Sammelrohrkarzinom oder Ductus-Bellini-Karzinom (um 1 %):
Das Sammelrohrkarzinom zeigt histologisch ein Mischbild aus dilatierten Tubuli und papillären Strukturen. Die Prognose ist sehr schlecht.
Medullärzelliges Nierenzellkarzinom (unter 1 %):
Das medullärzellige Nierenzellkarzinom tritt fast nur bei Sichelzellanämie auf und entspringt dem Kelchepithel in der Nähe der Papillen. Histologisch und prognostisch ist es dem Sammelrohrkarzinom ähnlich, manche Autoren halten es für einen Subtyp des Sammelrohrkarzinoms.
Muzinöses tubuläres und spindelzelliges Karzinom (unter 1%):
Der Tumortyp tritt vor allem bei Frauen unter 60 Jahren auf. Nicht aggressiver Tumor mit tubulären und spindelzelligen Anteilen, manche Autoren halten es für einen Subtyp des papillären Nierenzellkarzinoms.
Multilokuläre zystische renale Neoplasie mit niedrigem malignen Potential:
Zystischer Tumor mit low-grade Tumorzellen, in zahlreichen Studien ohne nachgewiesene Metastasierung, daher wird die alte Bezeichung multilokuläres zystisches Nierenzellkarzinom nicht mehr verwendet.
Nierenzellkarzinom mit MiT Translokationen:
Dieser Typ des Nierenzellkarzinoms ist definiert durch verschiedene Translokationen, welche u.a. das Chromosom Xp11.2 oder t(6;11) betreffen und zur Überexpression von Transkriptionsfaktoren der MiT Familie führen. Der Typ betrifft vor allem Kinder und Jugendliche und wird meist erst im fortgeschrittenen Stadium entdeckt.
Succinatdehydrogenase-defizientes Nierenzellkarzinom:
Succinatdehydrogenase-defiziente Nierenzellkarzinome sind durch einen Verlust der Expression von SDHB gekennzeichnet, einem Marker für mitochondriale Dysfunktion. Die soliden Tumoren haben eine braune Schnittfläche und zytoplasmatische Vakuolen. Betroffen sind vor allem junge Erwachsene, die meisten Patienten haben eine Keimbahnmutation. Die Prognose ist günstig.
Nicht klassifizierbare Nierenzellkarzinome:
4–7% der meist großen und undifferenzierten Nierenzellkarzinome können nicht eindeutig klassifiziert werden. Die Prognose ist schlecht (mittlere Überlebenszeit 4–5 Monate).
Onkozytom (5 %):
siehe Kapitel Onkozytom.Metastasierungsmuster des Nierenzellkarzinoms
In absteigender Häufigkeit: Lunge, Weichteile (Lymphknoten, Muskeln), Knochen, Leber, ZNS, Haut.
| Angiomyolipom | Suchen | Nierenzellkarzinom 2/4 |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur Nierenzellkarzinom
Algaba, F.; Akaza, H.; López-Beltrán, A.; Martignoni,
G.; Moch, H.; Montironi, R. & Reuter, V.
Current pathology keys of
renal cell carcinoma.
Eur Urol, 2011, 60, 634-643.
Badeloe, S. & Frank, J.
Clinical and molecular
genetic aspects of hereditary multiple cutaneous leiomyomatosis.
Eur
J Dermatol, 2009, 19, 545-551
DGU; DKG; DKG & Leitlinienprogramm Onkologie Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms, Langversion 4.02023 https://www.leitlinienprogramm-onkologie.de/leitlinien/nierenzellkarzinom/.
Eble, J. N.; Sauter, G.; Epstein, J. I. & Sesterhenn,
I. A. (ed.)
World Health Organization classification of tumours.
Pathology and genetics of tumours of the urinary system and male genital
organs
IARC Press, 2004.
Hock u.a. 2002 HOCK, L. M. ; LYNCH, J. ;
BALAJI, K. C.:
Increasing incidence of all stages of kidney cancer in the last 2
decades in the United States: an analysis of surveillance, epidemiology and
end results program data.
In: J Urol
167 (2002), Nr. 1, S. 57–60
B. Ljungberg et al., “EAU Guidelines: Renal Cell Carcinoma.” (2024). https://uroweb.org/guidelines/renal-cell-carcinoma/
Ljungberg, B.; Campbell, S. C.; Cho, H. Y.; Jacqmin,
D.; Lee, J. E.; Weikert, S. & Kiemeney, L. A.
The epidemiology of
renal cell carcinoma.
Eur Urol, 2011, 60, 615-621.
Menko, F. H.; van Steensel, M. A. M.; Giraud, S.;
Friis-Hansen, L.; Richard, S.; Ungari, S.; Nordenskjöld, M.; Hansen, T.
V.; Solly, J.; Maher, E. R. & Consortium, E. B.
Birt-Hogg-Dubé
syndrome: diagnosis and management.
Lancet Oncol, 2009,
10, 1199-1206.
Steffens, S.; Janssen, M.; Roos, F. C.; Becker, F.;
Schumacher, S.; Seidel, C.; Wegener, G.; Thüroff, J. W.; Hofmann, R.;
Stöckle, M.; Siemer, S.; Schrader, M.; Hartmann, A.; Kuczyk, M. A.;
Junker, K. & Schrader, A. J.
Incidence and long-term prognosis of
papillary compared to clear cell renal cell carcinoma - a multicentre study.
Eur
J Cancer, 2012, 48, 2347-2352.
Storkel u.a. 1997 STORKEL, S. ; EBLE, J. N. ;
ADLAKHA, K. ; AMIN, M. ; BLUTE, M. L. ;
BOSTWICK, D. G. ; DARSON, M. ; DELAHUNT, B. ;
ICZKOWSKI, K.:
Classification of renal cell carcinoma: Workgroup No. 1. Union
Internationale Contre le Cancer (UICC) and the American Joint Committee on
Cancer (AJCC).
In: Cancer
80 (1997), Nr. 5, S. 987–9
Verine, J.; Pluvinage, A.; Bousquet, G.; Lehmann-Che,
J.; de Bazelaire, C.; Soufir, N. & Mongiat-Artus, P.
Hereditary
renal cancer syndromes: an update of a systematic review.
Eur Urol, 2010,
58, 701-710.
 English Version: renal cell carcinoma
English Version: renal cell carcinoma
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.