Sie sind hier: Startseite > Prostata > Operationen > Prostatektomie > Laparoskopische Prostatektomie
Laparoskopische (roboter-assistierte) radikale Prostatektomie
Indikationen zur laparoskopischen Prostatektomie
Lokal begrenztes (nicht metastasiertes) Prostatakarzinom. Die Lebenserwartung sollte je nach Differenzierung mindestens 10–15 Jahre betragen. Ausführliche Darstellung der Therapieoptionen siehe Ausführliche Darstellung der Therapieoptionen siehe Kapitel Prostatakarzinom.
Kontraindikationen
Absolute Kontraindikationen sind unkorrigierte Gerinnungsstörungen und unbehandelte Harnwegsinfektionen. Weitere Kontraindikationen sind abhängig von den Grunderkrankungen (Operationsrisiko) und der Bedeutung der Prostatektomie für die Lebenserwartung des Patienten. Spezifische relative Kontraindikationen für die laparoskopische Prostatektomie (in Abhängigkeit von der Expertise) sind komplexe Voroperationen im Becken, morbide Adipositas, sehr große Prostatadrüsen und nach Strahlentherapie der Prostata.
Technik der laparoskopischen Prostatektomie
Die folgende Darstellung der laparoskopischen transperitonealen Technik ist modifiziert nach (Türk u.a., 2001) (Guillonneau und Vallancien, 2000b) (Guillonneau und Vallancien, 2000a). Technische Alternativen sind die extraperitoneale endoskopische Prostatektomie (Stolzenburg u.a., 2007) und die roboter-assistierte laparoskopische oder endoskopische Prostatektomie (Zorn u.a., 2009). Alle genannten Techniken unterscheiden sich in Details hinsichtlich des Zugangs, die Dissektionsgrenzen an der Prostata sind jedoch gleich.
Operationszeitpunkt:
Eine nervenerhaltende laparoskopische Prostatektomie sollte frühestens 8 Wochen nach Prostatabiopsie und 3 Monate nach TURP durchgeführt werden. Dadurch werden Verwachsungen der Prostata mit der Umgebung und dem Gefäßnervenbündel reduziert.
Präoperative Vorbereitung:
Zwei Tage vor dem Eingriff ballaststoffarme Diät, am präoperativen Tag klare (energiereiche) Flüssigkeiten (Wasser, Säfte, Brühe) und ein Einlauf am Abend vor der Operation. Perioperativ wird eine Magensonde gelegt. Perioperative Antibiotikaprophylaxe. Allgemeinanästhesie.
Lagerung:
Rückenlage mit leichter Überstreckung der Lendenwirbelsäule. Fixierung durch Gurte über Brust, Becken und Waden mit angelagerten Armen, sodass eine Trendelenburg-Lagerung möglich ist. Desinfektion des Abdomens und steriles Abdecken. Einlegen eines DK.
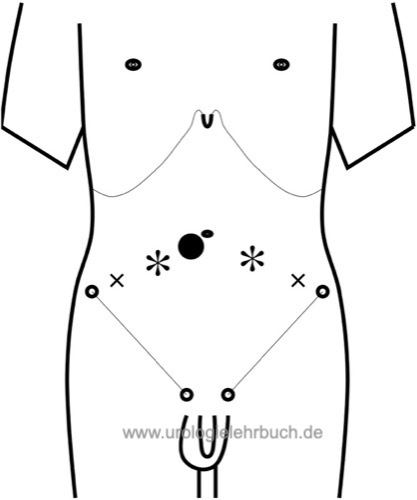
Trokarpositionen:
Anlage eines Pneumoperitoneums mittels Verres-Nadel oder Minilaparotomie, der Optiktrokar wird umbilikal positioniert. Trendelenburg-Lagerung nach Anlage eines Pneumoperitoneums. Zwei Arbeitskanäle 10 mm links und rechts latero-distal des Nabels, zwei Arbeitskanäle 5 mm links und rechts lateral der 10 mm Arbeitskanäle. Siehe Abb. Trokarpositionen laparoskop. Prostatektomie.
 |
Pelvine Lymphadenektomie:
Siehe laparoskopische pelvine Lymphadenektomie.
Präparation der Samenblasen:
Inzision des Peritoneums entlang des Samenleiterverlaufes in den Douglas-Raum bds., die Inzision wird über die Mittellinie mit der Gegenseite vereinigt. Durchtrennung der Samenleiter unterhalb der Beckengefäßachse und Freilegung bis zu den Vesiculae seminales. Die Samenblasen werden nach Inzision des umgebenden Bindegewebes entlang der Längsachse mobilisiert und die von lateral einstrahlende Blutversorgung durch Ligaturclips versorgt. Der Assistent zieht mit den Samenleitern die Prostata nach kranial, dadurch spannt sich die Denovilliers-Faszie unterhalb der Samenblasen auf. Die Denovilliers-Faszie wird transversal unterhalb der Samenblasen durchtrennt. Mit dem Präparationstupfer kann die Prostata vom Rektum stumpf abpräpariert werden.
Ventrale Prostatapräparation:
Die Harnblase wird mit 200 ml H2O gefüllt und das parietale Peritoneum um die Harnblase inzidiert. Der Urachus wird so kranial als möglich durchtrennt. Die Inzision wird beidseits bis zur Plica umbilicalis medialis erweitert, ohne diese zu durchtrennen. Nach dem Auffinden des prävesikalen Raumes (Spatium retropubicum) wird die Harnblase von der Bauchwand gelöst und die Präparation nach kaudal bis zur endopelvinen Faszie und Prostata fortgesetzt.
Die Harnblase wird wieder entleert und der Assistent verlagert mit dem Endoretraktor die Harnblase nach kranial. Die ventrale Fläche der Prostata wird von Fett befreit, oberflächliche Venen werden nach Koagulation durchtrennt. Die endopelvine Faszie wird bds. lateral der Prostata eröffnet und die Beckenbodenmuskulatur von der Prostata abgeschoben. Laterale Anteile des puboprostatischen Ligaments werden bds. nach Koagulation durchtrennt. Der dorsale Venenplexus wird mit einer Durchstichligatur (Vicryl 1–0) versorgt.
Harnblasenhalspräparation:
durch Zug am Katheter wird die Grenze zwischen Harnblase und Prostata sichtbar, dort wird die Harnblasenmuskulatur von der Prostata abpräpariert. Blutungen werden bipolar koaguliert (alternativ: Ultraschallskalpell). Nach Eröffnung der Harnblase wird der Katheter entblockt, vom Assistenten gegriffen und zur Symphyse gezogen. Soweit übersichtlich wird die Präparation des Harnblasenhalses nach lateral fortgeführt. Die posteriore Wand des Blasenhalses wird nach Identifikation der Ostien inzidiert. Die Präparation wird streng nach posterior fortgeführt, bis die bereits präparierten Samenblasen und Samenleiter sichtbar werden. Der Assistent greift die Samenwege und zieht sie gen Symphyse. Nun straffen sich lateral die beiden Prostatapedikel.
Durchtrennung der Prostatapedikel:
Die angespannten Prostatapedikel werden zwischen Clips schrittweise durchtrennt (Alternativ Ultraschallskalpell).
Nervenschonung:
die Präparationsrichtung bei Durchtrennung der Prostatapedikel ist initial streng nach lateral entlang des Harnblasenhalses, dann allmählich nach distal dorsal abbiegend um tangential entlang des N. cavernosus zu präparieren. Das Nerven-Gefäßbündel liegt lateral der Pedikelgefäße von einer dünnen Fettlamelle umgeben. Die Präparation wird so weit als möglich nach apikal durchgeführt.
Präparation des Prostataapex:
Der Plexus Santorini wird mit ausreichendem Abstand von der Ligatur tangential zur Prostataoberfläche durchtrennt, sodass der Apex mit Harnröhrenübergang dargestellt werden kann. Die Harnröhre wird mit der Schere eröffnet, der DK entfernt und danach die hintere Wand der Harnröhre durchtrennt. Die fehlende Prostatapräparation wird vollendet, die mobilisierte Prostata wird in einem Bergebeutel in der Fossa iliaca zwischengelagert.
Vesikourethrale Anastomose:
Die Rekonstruktion der dorsalen Gewebestrukturen vor der eigentlichen Anastomose (dorsale Sphinkterfasern mit der Denovilliers-Faszie) soll die Frühkontinenz und Dichtigkeit der Anastomose verbessern (Rocco u.a., 2009). Bei der Erstbeschreibung wurde die Anastomose mit Einzelknopfnächten durchgeführt. Einfacher und schneller ist die vesikourethrale Anastomose mit einer fortlaufenden doppelt-armierten Monofilamentnaht mit Widerhaken. Die Naht beginnt dorsal und wird beidseits fortlaufend über die seitliche Urethra bis nach ventral geführt, wo beide Nähte miteinander verknotet werden. Vor Vollendung der Anastomose wird ein 20 CH Katheter eingelegt, er dient auch als Orientierungshilfe für die letzten Stiche. Bei weitem Harnblasenhals wird im Sinne einer "tennis racket" Naht der Harnblasenhals ventral verschlossen. Die Anastomose wird mit einer Harnblasenfüllung überprüft.
Organbergung und Wundverschluss:
Die Prostata wird über einen 10 mm Trokar nach Schnitterweiterung in Wechselschnitttechnik geborgen. Schichtweiser Wundverschluss. Verringerung des Gasdrucks auf 5 mm Hg und Kontrolle der Hämostase. Über einen lateralen 5 mm Port wird eine Robinson-Drainage in das kleine Becken eingelegt. Faszienverschluss der 10 mm Arbeitskanälen.
Technische Modifikationen:
Folgende technische Modifikationen der laparoskopischen Prostatektomie werden einzeln und auch in Kombination angewendet:
- Roboter-assistierte Laparoskopie: die dreidimensionale Sicht, artikulierte Instrumente mit mehreren Freiheitsgraden, ein ausgefilterter Handtremor und die ergonomische Arbeitsposition vereinfachen die laparoskopische Operation. Die roboter-assistierte Prostatektomie wurde in vielen Teilen der Welt zur Standardtechnik.
- Extraperitoneale endoskopische Prostatektomie: die Vermeidung der transperitonealen Präparation senkt das Risiko für Komplikationen wie Darmverletzung oder postoperativer Ileus. Sie ist besonders vorteilhaft bei adipösen Patienten und nach größeren intraabdominellen Operationen.
- Single-Port Laparoskopie: die Operation wird über einen Trokar mit mehreren Kanälen und mit speziellen angulierten Instrumenten durchgeführt. Auch für die roboter-assistierte Laparoskopie steht eine Single-port Plattform zur Verfügung (Dobbs u.a., 2020).
- Transvesikale endoskopische radikale Prostatektomie: mit der roboter-assistierten Single-port Plattform (Kaouk et al., 2021).
Nachsorge der laparoskopischen Prostatektomie
Allgemeine Maßnahmen:
Frühe Mobilisation. Thromboseprophylaxe, Heparin-Injektionen nur in die obere Extremität. Laborkontrollen (Hb). Wundkontrollen und regelmäßige Untersuchung des Abdomens.
Analgesie:
Schmerztherapie mit einer Kombination aus Nichtopioid-Analgetika und Opioid-Analgetika.
Kostaufbau:
erster pOP klare Flüssigkeiten, zweiter pOP fettarme Diät, dritter Tag Vollkost. Macrogol zur Stuhlerweichung.
Drainagen und Katheter:
Drainagen 1–2 Tage. Bei vermehrter seröser Sekretion Bestimmung des Kreatinins aus der Drainageflüssigkeit vor Entfernung der Drainage.
Katheterentfernung nach 7 Tagen, vorher Prüfung der Dichtigkeit mit einem MCU.
Onkologische Ergebnisse
Siehe Kapitel Prostatakarzinom.
Komplikationen der laparoskopischen Prostatektomie
Prinzipiell sind die gleichen Komplikationen wie bei der retropubischen radikalen Prostatektomie zu erwarten, siehe Kapitel retropubische radikale Prostatektomie. Das laparoskopische (roboter-assistierte) Verfahren hat Vorteile hinsichtlich des Blutverlustes, der Dauer des stationären Aufenthalts, der Katheterverweildauer und der allgemeinen Rekonvaleszenzzeit. In großen vergleichenden Studien wurden keine oder keine relevanten Unterschiede hinsichtlich Potenz, Kontinenz oder onkologischer Heilung gefunden (DellOglio u.a., 2020). Die prospektiv-kontrollierte LAPPRO-Studie fand keine relevanten Unterschiede bezüglich des Hernienrisikos (7,3–8,4%) nach offen-chirurgischer oder roboter-assistierter laparoskopischer Technik (Nilsson u.a., 2022).
| lap. pelvine Lymphadenektomie | Suchen | Perineale Prostatektomie |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur laparoskopische Prostatektomie
P. Dell’Oglio, A. Mottrie, and E. Mazzone, “Robot-assisted radical prostatectomy vs. open radical prostatectomy: latest evidences on perioperative, functional and oncological outcomes.,” Current opinion in urology, vol. 30, no. 1, pp. 73–78, 2020, doi: 10.1097/MOU.0000000000000688.
Guillonneau und Vallancien 2000a
GUILLONNEAU, B. ; VALLANCIEN, G.:
Laparoscopic radical prostatectomy: the Montsouris experience.
In: J Urol
163 (2000), Feb, Nr. 2, S. 418–422
Guillonneau und Vallancien 2000b
GUILLONNEAU, B. ; VALLANCIEN, G.:
Laparoscopic radical prostatectomy: the Montsouris technique.
In: J Urol
163 (2000), Jun, Nr. 6, S. 1643–1649
H. Nilsson et al., “Risk of hernia formation after radical prostatectomy: a comparison between open and robot-assisted laparoscopic radical prostatectomy within the prospectively controlled LAPPRO trial.,” Hernia, vol. 26, no. 1, pp. 157–164, 2022, doi: 10.1007/s10029-020-02178-7.
Rocco, F. & Rocco, B.
Anatomical reconstruction
of the rhabdosphincter after radical prostatectomy.
BJU Int, 2009,
104, 274-281.
J. A. Smith, S. S. Howards, G. M. Preminger, and R. R. Dmochowski, Hinman’s Atlas of Urologic Surgery Revised Reprint. Elsevier, 2019.
Stolzenburg, J.; Rabenalt, R.; Do, M.; Truss, M. C.;
Burchardt, M.; Herrmann, T. R.; Schwalenberg, T.; Kallidonis, P. &
Liatsikos, E. N.
Endoscopic extraperitoneal radical prostatectomy: the
University of Leipzig experience of 1,300 cases.
World J Urol, 2007,
25, 45-51.
Türk u.a. 2001 TüRK, I. ; DEGER, S. ;
WINKELMANN, B. ; SCHöNBERGER, B. ; LOENING,
S. A.:
Laparoscopic radical prostatectomy. Technical aspects and experience
with 125 cases.
In: Eur Urol
40 (2001), Jul, Nr. 1, S. 46–52; discussion 53
Zorn, K. C.; Gautam, G.; Shalhav, A. L.; Clayman, R. V.; Ahlering, T. E.; Albala, D. M.; Lee, D. I.; Sundaram, C. P.; Matin, S.
F.; Castle, E. P.; Winfield, H. N.; Gettman, M. T.; Lee, B. R.; Thomas,
R.; Patel, V. R.; Leveillee, R. J.; Wong, C.; Badlani, G. H.; Rha, K. H.;
Eggener, S. E.; Wiklund, P.; Mottrie, A.; Atug, F.; Kural, A. R.; Joseph,
J. V. & of the Society of Urologic Robotic Surgeons, M.
Training,
credentialing, proctoring and medicolegal risks of robotic urological
surgery: recommendations of the society of urologic robotic surgeons.
J
Urol, 2009, 182, 1126-1132.
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.