Sie sind hier: Startseite > Nieren > Nierenzellkarzinom > operative Therapie
Therapie des Nierenzellkarzinoms durch Operationen
- Nierenzellkarzinom: Ursachen und Pathologie
- Nierenkrebs: Symptome und Diagnose
- Nierenzellkarzinom: operative Therapie
- Nierenzellkarzinom: Therapie des metastasierten Nierenzellkarzinoms
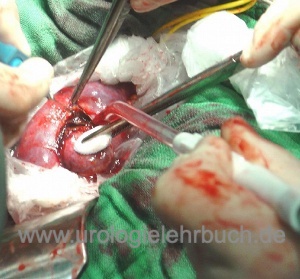 |
Übersicht über die operativen Therapieoptionen
Operation von unilateralen kleinen Nierentumoren:
Die offene oder laparoskopische Nierenteilresektion ist der Therapiestandard, je nach technischer Expertise des Operierenden [siehe Abschnitt Nierenteilresektion]. Günstig gelegene Tumoren können mit der Radiofrequenzablation oder Kryotherapie behandelt werden. Bei älteren Patienten mit signifikanter Komorbidität ist die aktive Überwachung möglich.
Operation von großen unilateralen Nierentumoren:
Die Tumornephrektomie ist der Therapiestandard für große Tumoren oder Tumoren mit Venenthrombus. Je nach Krankheitsstadium und technischer Expertise des Operierenden kann die Tumornephrektomie laparoskopisch, retroperitoneoskopisch, offen-chirugisch lumbal oder transperitoneal durchgeführt werden, siehe Abschnitt Tumornephrektomie.
Operative Therapie bei bilateralen Nierentumoren:
Eine organerhaltene Nierenteilresektion sollte beidseits angestrebt werden. Falls dies technisch nicht möglich erscheint, wird zunächst auf der technisch einfacheren Seite eine Nierenteilresektion durchgeführt. Dies vermeidet eine dialysepflichtige Phase durch eine passagere ischämische Niereninsuffizienz (mit Hilfe der kontralateralen ebenfalls tumorbefallenen Niere). Nach einem Monat Evaluation der Nierenrestfunktion (Funktionsszintigraphie). Bei ausreichender Nierenrestfunktion der bereits operierten Seite kann eine Tumornephrektomie auf der kontrallateralen Seite durchgeführt werden. Bei unzureichender Nierenrestfunktion sollte eine imperative Nierenteilresektion (unter Verwendung aller technischen Möglichkeiten) der kontralateralen Seite angestrebt werden, alterativ Tumornephrektomie mit anschließender Dialyse.
Operation bei metastasierten Nierentumoren:
Vor Beginn einer systemischen Therapie sollten alle chirurgischen Therapieoptionen ausgereizt werden, wenn damit signifikant die Tumorlast gesenkt werden kann und der Patient in gutem Allgemeinzustand ist: zytoreduktive Tumornephrektomie, Lymphadenektomie von vergrößerten Lymphknoten und Resektion von einzelnen oder mehreren Metastasen. Nicht sinnvoll ist ein operatives Vorgehen bei disseminierter Erkrankung mit schlechter Prognose nach Motzer (siehe Tab. Motzer-Kriterien). Falls mit der operativen Therapie alle Tumormanifestationen entfernt werden konnten, besteht die Option einer adjuvanten Therapie mit Pembrolizumab. Operativ nicht entfernbare Metastasen werden systemisch mit Inhibitoren der Operativ nicht entfernbare Metastasen werden systemisch mit Inhibitoren der Signaltransduktion und des Immun-Checkpoints behandelt.
Komplette Operation: Radikale Tumornephrektomie
Indikation zur Tumornephrektomie:
Die Radikale Tumornephrektomie ist Therapiestandard für große Tumoren oder Tumoren mit Venenthrombus.
Relative Kontraindikationen für die Tumornephrektomie:
gute Möglichkeit der organerhaltenden Nierenteilresektion bei kleinen Tumoren, insbesondere bei (drohender) Niereninsuffizienz. Risikofaktoren für eine zukünftige Niereninsuffizienz nach Nephrektomie sind erhöhte Kreatininwerte, Proteinurie, Diabetes mellitus, arterieller Hypertonus, beidseitige Nierenzellkarzinome oder familiäres Nierenzellkarzinom.
Technik der Tumornephrektomie:
Laparoskopische oder retroperitoneoskopische Tumornephrektomie [siehe Kapitel Laparoskopische Tumornephrektomie], alternativ und bei sehr großen Tumoren lumbale, transperitoneale oder thorakoabdominale Tumornephrektomie (Robson u.a., 2002).
Die laparoskopische oder retroperitoneoskopische Tumornephrektomie hat eine geringere Morbidität und ist onkologisch gleichwertig (Hemal u.a., 2007). Zwischen der laparoskopischen oder retroperitoneoskopischen Tumornephrektomie konnten keine signifikanten klinischen Unterschiede gefunden werden (Desai u.a., 2005). Die laparoskopische Tumornephrektomie ist inzwischen die Technik der ersten Wahl bei T1–2-Nierentumoren, welche ungeeignet für eine Nierenteilresektion sind und wenn die Tumorgröße die endoskopische Technik zulässt (EAU-Leitlinie, Ljungberg u.a.,2010).
Veneninvasion des Nierenzellkarzinoms:
Die Ausklemmen des Tumorzapfens ist Voraussetzung für die Tumornephrektomie, Eröffnung der Vena cava und Entfernung des Tumorzapfens. Wichtig für die operative Planung ist die genaue Bestimmung der kranialen Ausdehnung:
- Level I: Vena renalis
- Level II: Vena cava inferior unterhalb der Leber
- Level III: intrahepatische Vena cava unter dem Diaphragma, Zwei-Höhlen-Eingriff zur Ausklemmung notwendig
- Level IV: Tumorthrombus über dem Diaphragma: Zwei-Höhlen-Eingriff mit Herz-Lungen-Maschine notwendig
Adrenalektomie im Rahmen der Tumornephrektomie:
Die Notwendigkeit einer routinemäßigen Adrenalektomie wird heute kaum noch gesehen. Der Befall der Nebenniere (1–3 %) ist praktisch nie Ausdruck eines kontinuierlichen Tumorwachstums, sondern Zeichen der Metastasierung mit schlechter Prognose (Han u.a. 2003). Die Wahrscheinlichkeit der korrekten bildgebenden Erfassung mittels einer CT liegt bei 97 %. Bei Nachweis eines Nebennierenbefalls wird bei indizierter Operation des Primärtumors auch adrenalektomiert.
Regionäre Lymphadenektomie:
Bei Tumoren mit T1–2 cN0 soll keine Lymphadenektomie durchgeführt werden, da in einer großen EORTC-Studie kein Überlebensvorteil demonstriert werden konnte (Blom u.a., 1999 und 2009). Manche Autoren befürworten aufgrund retrospektiver Daten eine ausführliche Lymphadenektomie vom Zwerchfellursprung bis zum Abgang der A. mesenterica inf. bei fortgeschrittenen Tumoren oder vergrößerten Lymphknoten. Bei linksseitigen Tumoren werden die paraaortalen Lymphknoten entfernt, bei rechtsseitigen Tumoren werden die parakavalen Lymphknoten entfernt und für beide Seiten sollen die interaortokavalen Lymphknoten entfernt werden (Capitanio u.a., 2011).
Onkologische Ergebnisse nach Tumornephrektomie:
Siehe Tab. Überleben in Anhängigkeit des klinischen Stadiums für die tumorspezifischen Überlebensraten. Genauere Ergebnisse für die Überlebenswahrscheinlichkeit sind durch die Berücksichtigung von mehreren Risikofaktoren möglich, siehe Stage, Size, Grade, and Necrosis (SSIGN) Score [Tabellen Ermittlung des SSIGN Score und Überleben und SSIGN Score].
| Klinisches Tumorstadium | 5JÜR |
| Stadium I (begrenzt auf die Niere) | 75–92 % |
| Stadium II (innerh. Fascia renalis) | 63–77 % |
| Stadium III (Veneninvasion, pN+) | 38–47 % |
| Stadium IV (pT4 oder M1) | 11–12 % |
| Risikofaktor | Punkte |
| T-Stadium | |
| T1 | 0 |
| T2 | 1 |
| T3 | 2 |
| T4 | 4 |
| Lymphknotenstatus | |
| pNx oder pN0 | 0 |
| pN1 oder pN2 | 2 |
| Metastasen | |
| M0 | 0 |
| M1 | 4 |
| Tumorgröße | |
| <5 cm | 0 |
| >5 cm | 2 |
| Grading | |
| Grade 1–2 | 0 |
| Grade 3 | 1 |
| Grade 4 | 3 |
| Tumornekrosen | |
| Keine Nekrosen | 0 |
| Nekrosen | 2 |
| SSIGN-Score | 1 Jahr | 5 Jahre | 10 Jahre |
| 0–2 | 99% | 97% | 94% |
| 3–4 | 98% | 90% | 78% |
| 5–6 | 93% | 74% | 57% |
| 7–9 | 77% | 39% | 26% |
| >10 | 43% | 19% | 19% |
Adjuvante Therapie nach Tumornephrektomie:
Bei fortgeschrittenen Nierenzellkarzinomen ist das Progressionsrisiko sehr hoch, die therapeutischen Optionen beim metastasierten Nierenzellkarzinom sind begrenzt. Das Tumorrezidiv ist unter anderem abhängig von der Funktion des Immunsystems und somit durch eine adjuvante Therapie theoretisch beeinflussbar.
Adjuvante Therapie mit Checkpoint-Inhibitoren
Die Keynote-564 ist die erste Phase-III Studie mit einer verbesserten krankheitsfreien Überleben (HR 0,72) und einem verbessertem Gesamtüberleben (91% vs. 86% OS nach vier Jahren) durch die adjuvante Therapie mit Pembrolizumab nach operativer Therapie (Choureiri u.a., 2024). Eingeschlossen wurden Patienten mit entdifferenziertem Tumoren (Grad 4), T3-4, N+ oder nach vollständiger Metastasenresektion. Die Zulassung wurde 11/2021 durch die FDA und 2/2022 durch die EMA ausgesprochen. Es gibt gewichtige Nachteile für eine frühe adjuvante Therapie mit Pembrolizumab: Übertherapie der nichtmetastasierten Patienten, Untertherapie der metastasierten Patienten (kein TKI) und hohe Kosten von über 100000 Euro.
Adjuvante Therapie mit Tyrosinkinasehemmern
Mehrere randomisierte Studien untersuchten die adjuvante Therapie mit Inhibitoren der Signaltransduktion bei Patienten mit hohem Progressionsrisiko nach operativer Therapie: ASSURE (Sunitinib vs. Sorafenib vs. Placebo) zeigte keine signifikanten Vorteile (Haas u.a., 2017). PROTECT (Pazopanib vs. Placebo) führte zu einer Verbesserung des progressionsfreien Überleben (HR 0,69), aber ein Unterschied im Gesamtüberleben konnte nicht nachgewiesen werden (Motzer u.a., 2017). S-TRAC (Sunitinib vs. Placebo) konnte eine Verbesserung des progressionsfreien Überleben demonstrieren (97 vs. 122 von 615 Patienten entwickelten Metastasen), das Gesamtüberleben wurde noch nicht publiziert (Motzer u.a., 2018). In den adjuvanten Therapiegruppen wurden signifkante Nebenwirkungen bei langfristiger Gabe von TKI nachgewiesen, so dass aktuell von einer adjuvanten Therapie außerhalb von Studien abgeraten wird und dafür auch keine Zulassung existiert (Sun u.a., 2018).
Nachsorge nach radikaler Operation:
Es existieren keine festen Empfehlungen für die Nachsorge des Nierenzellkarzinoms. Nach Empfehlungen der EAU und der deutschen S3-Leitlinie soll die Nachsorge nach Tumornephrektomie in Abhängigkeit der Beschwerden und Metastasierungswahrscheinlichkeit durchgeführt werden. Die Metastasierungswahrscheinlichkeit kann mit den Tabellen Ermittlung des SSIGN Score und Überleben und SSIGN Score eingeschätzt werden. Der folgende Vorschlag für beschwerdefreie Patienten ist modifiziert nach der deutschen S3-Leitlinie:
Bei niedrigem Risiko beträgt die Dauer der Nachsorgen 5 Jahre. Klinische Untersuchungen, Laborkontrollen und Ultraschallkontrollen werden in den Monaten 3, 6, 12, 24, 36, 48 und 60 empfohlen. Die EAU-Leitlinie empfiehlt eine CT-Untersuchung nur bei rezidivtypischen Symptomen. Die S3-Leitlinie empfiehlt ein CT-Thorax und Abdomen nach 1, 2 und 4 Jahren.
Bei mittlerem und hohem Risiko beträgt die Dauer der Nachsorgen 9 Jahre. Klinische Untersuchungen, Laborkontrollen und Ultraschallkontrollen werden in den Monaten 3, 6, 12, 24, 36, 48, 60, 84 und 108 empfohlen. CT-Thorax und Abdomen nach 1, 2, 3, 4, 5, 7 und 9 Jahren. Bei hohem Risiko zusätzlich CT-Thorax in den Monaten 6 und 18. Bei Knochenschmerzen ist eine Knochenszintigraphie indiziert.
Organerhalt: Nierenteilresektion
Imperative Indikationen zur Nierenteilresektion:
Vermeidung einer dialysepflichtigen Niereninsuffizienz durch die operative Therapie des Nierenzellkarzinoms. Falls onkologisch möglich, ist eine Nierenteilresektion dringend indiziert bei:
- Einzelnieren
- kompensierter Niereninsuffizienz
- bilateralen Tumoren
- Familiäres Nierenzellkarzinom
- bekannten benignen Nierenerkrankungen mit drohender zukünftiger Niereninsuffizienz (z.B. Diabetes mellitus oder Nierenarterienstenose)
Elektive Indikation zur Nierenteilresektion:
Die S3-Leitlinie gibt der Nierenteilresektion bei lokalisiertem Nierenzellkarzinom klar den Vorzug. Falls technisch möglich, soll bei T1-Tumoren und sollte bei T2-Tumoren eine Nierenteilresektion anstatt einer Tumornephrektomie durchgeführt werden (DGU 2015). Retrospektive Vergleiche zwischen Tumornephrektomie und Nierenteilresektion bei T1-Tumoren zeigten eine bessere Überlebensrate von Patienten nach Nierenteilresektion. Dies wird mit einer Verminderung von kardiovaskulären Erkrankungen durch eine bessere Nierenfunktion erklärt (Zini u.a., 2009) (Weight u.a., 2010) (Sun u.a., 2012). Die randomisierte EORTC-Studie (Tumornephrektomie vs. Nierenteilresektion) konnte diesen Effekt nicht demonstrieren (van Poppel u.a., 2011).
Technik der Nierenteilresektion:
Offene Nierenteilresektion: lumbale oder, weniger häufig, transperitoneale Nierenfreilegung. Kontrolle und Anzügeln der Hilusgefäße. Exzision des Tumors mit oder ohne Ischämie je nach Tumorgröße und Lokalisation. Ein Sicherheitsabstand zum Tumor ist nicht notwendig, die Enukleation des Tumors in seiner Pseudokapsel ist statthaft (Minervini u.a., 2012). Wichtig ist ein makroskopisch tumorfreier Absetzungsrand siehe auch Abschnitt Nierenteilresektion.
In günstigen Fällen (peripherer kleiner Nierentumor) können alternativ die laparoskopische oder retroperitoneoskopische Nierenteilresektion zur Anwendung kommen. Bisherige retrospektive Vergleiche fanden jedoch eine längere intraoperative Ischämiezeit und vermehrt intra- und postoperative Komplikationen im Vergleich zur offenen Technik (Gill u.a., 2003). Die Patientenselektion ist wichtig um die Komplikationsrate und Ischämiedauer zu minimieren. Die roboterassistierte Laparoskopie ist eine vielversprechende Technik, welche die Laparoskopie vereinfacht und komplexe Nierenteilresektion von zentralen Tumoren ermöglicht.
Vorgehen bei bilateralem Nierenzellkarzinom:
zunächst wird die technisch einfachere Nierenteilresektion durchgeführt. Dies vermeidet eine dialysepflichtige Phase durch eine passagere ischämische Niereninsuffizienz (mit Hilfe der kontralateralen ebenfalls tumorbefallenen Niere).
Nach einem Monat Evaluation der Nierenrestfunktion (Funktionsszintigraphie). Bei ausreichender Nierenrestfunktion kann eine Tumornephrektomie durchgeführt werden. Bei unzureichender Nierenrestfunktion wird eine Nierenteilresektion der kontralateralen Seite versucht, falls onkologisch möglich.
Onkologische Ergebnisse nach Nierenteilresektion:
In der randomisierten EORTC-Studie (Tumornephrektomie vs. Nierenteilresektion, n=541) konnte die onkologische Sicherheit der Nierenteilresektion nachgewiesen werden (van Poppel u.a., 2011): nur 12 von 117 Todesfälle waren durch ein fortgeschrittenes Nierenzellkarzinom verursacht (4 vs. 8). 21 Patienten erlebten einen Tumorprogress (9 vs. 12). Die onkologischen Ergebnisse sind wie bei der Tumornephrektomie in Abhängigkeit des Tumorstadiums, siehe Tab. onkologische Ergebnisse nach Nierenteilresektion. In einzelnen Serien bewegt sich das Lokalrezidiv nach Nierenteilresektion zwischen 1,4 % und 10 %, je nach Patientenkollektiv und maximaler Tumorgröße. Das Überleben wird zum überwiegenden Anteil durch das Auftreten von Fernmetastasen bestimmt, welche i. d. R. ohne lokales Rezidiv entstehen.
Bedeutung von positiven Schnitträndern:
Die Nierenteilresektion kann gemäß S3-Leitlinie ohne Schnellschnittuntersuchung durchgeführt werden, wenn intraoperativ makroskopisch eine R0-Resektion erreicht werden kann. Das Risiko einer mikroskopischen R1-Resektion liegt dann in Anhängigkeit der Tumorgröße und des Grading bei 0–7%. Das tumorspezifische Überleben wird jedoch nicht durch das Vorliegen des R1-Befundes entscheidend beeinflusst, die wichtigen Variablen bleiben Tumorgröße und Grading. Eine prophylaktische sekundäre Nephrektomie im Falle eines mikroskopischen R1-Befundes wird nicht empfohlen, es genügen Tumornachsorgen und die zweizeitige Nephrektomie bei Lokalrezidiv (DGU 2015).
| Tumorgröße | 5JÜR | 10JÜR |
| T1a (<4cm) | 96 % | 90 % |
| T1b (>4cm) | 86 % | 66 % |
Nachsorge nach Nierenteilresektion:
Bei knapper Nierenteilresektion oder R1-Resektion ist 3 Monate nach Nierenteilresektion ein CT-Abdomen als Ausgangsbefund sinnvoll. Nach Empfehlungen der EAU (Ljungberg u.a., 2016) und der deutschen S3-Leitlinie soll die Nachsorge nach Nierenteilresektion in Abhängigkeit der Beschwerden und der Metastasierungswahrscheinlichkeit durchgeführt werden. Die Metastasierungswahrscheinlichkeit kann mit dem SSIGN-Score eingeschätzt werden siehe Nachsorgeempfehlungen nach Tumornephrektomie.
Experimentelle Therapie für lokalisierte Nierenzellkarzinome
Zur Auswahl stehen die Kryotherapie, die Radiofrequenzablation und die aktive Überwachung. Die S3-Leitlinie empfiehlt eine Biopsie des Tumors vor Beginn invasiver Therapieoptionen, da die Komplikationsrate bis zu 20% beträgt. Für alle genannten Therapieoptionen fehlen Langzeitergebnisse.
Kryotherapie des Nierenzellkarzinoms:
perkutane oder laparoskopische Applikation von Kälte. Für die Zellzerstörung sind das schnelle Abkühlen des Gewebes, das allmähliche Erwärmen und die Wiederholung der Gefrier-Tau-Sequenzen entscheidend. Das gefrorene Gewebe wird vom Körper abgebaut und durch Granulationsgewebe ersetzt. Es ergeben sich Vorteile für die laparoskopische Applikation: die freipräparierte Niere kann besser gekühlt werden, das Risiko für Nachbarorganverletzungen ist minimiert und es besteht eine Sichtkontrolle der Eisballentstehung in Korrelation zu den Tumorgrenzen.
Radiofrequenzablation des Nierenzellkarzinoms:
Periphere Tumoren bis 5 cm können therapiert werden. Im Vergleich zur Kryotherapie ist die Kontrolle des Therapieeffekts schwerer. Die Erfahrungen in dieser neuen Technik sind limitiert, Langzeitergebnisse oder vergleichende Studien stehen noch aus.
Aktive Überwachung bei T1a-Nierenzellkarzinom:
Bei ausgeprägter Komorbidität und hohem Alter ist die aktive Überwachung eine Therapieoption bei kleinen Nierentumoren. Bei einem Tumordurchmesser unter 3 cm sind 22–46% der Nierentumoren gutartig. Im Falle eines Nierenzellkarzinoms sind unter 10% schlecht differenziert [Tab. Tumorpathologie in Abhängigkeit des Durchmessers]. Die aktive Überwachung sollte bei einem deutlichen Größenwachstum des Primärtumors und bei einem Tumordurchmesser von über 3–4 cm überdacht werden.
| Nierenzellkarzinom 2/4 | Suchen | Nierenzellkarzinom 4/4 |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur Nierenzellkarzinom
Blom u.a. 1999 BLOM, J. H. ; POPPEL, H. van ;
MARECHAL, J. M. ; JACQMIN, D. ; SYLVESTER, R. ;
SCHRODER, F. H. ; PRIJCK, L. de:
Radical nephrectomy with and without lymph node dissection:
preliminary results of the EORTC randomized phase III protocol 30881. EORTC
Genitourinary Group.
In: Eur Urol
36 (1999), Nr. 6, S. 570–5
Blom, Jan H M; van Poppel, Hein; Maréchal, Jean M;
Jacqmin, Didier; Schröder, Fritz H; de Prijck, Linda; Sylvester, Richard &
E. O. R. T. C. Genitourinary Tract Cancer Group
Radical nephrectomy
with and without lymph-node dissection: final results of European
Organization for Research and Treatment of Cancer (EORTC) randomized phase
3 trial 30881.
Eur Urol, 2009, 55, 28-34.
Capitanio, U.; Becker, F.; Blute, M. L.; Mulders, P.;
Patard, J.; Russo, P.; Studer, U. E. & Poppel, H. V.
Lymph node
dissection in renal cell carcinoma.
Eur Urol, 2011,
60, 1212-1220.
Choueiri TK, Tomczak P, et al., KEYNOTE-564 Investigators. Overall Survival with Adjuvant Pembrolizumab in Renal-Cell Carcinoma. N Engl J Med. 2024 Apr 18;390(15):1359-1371. doi: 10.1056/NEJMoa2312695.
DGU; DKG; DKG & Leitlinienprogramm Onkologie Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms, Langversion 4.02023 https://www.leitlinienprogramm-onkologie.de/leitlinien/nierenzellkarzinom/.
Gill, I. S.; Matin, S. F.; Desai, M. M.; Kaouk, J. H.;
Steinberg, A.; Mascha, E.; Thornton, J.; Sherief, M. H.; Strzempkowski, B.
& Novick, A. C.
Comparative analysis of laparoscopic versus open
partial nephrectomy for renal tumors in 200 patients.
J Urol, 2003,
170, 64-68.
Guinan u.a. 1995 GUINAN, P. D. ; VOGELZANG,
N. J. ; FREMGEN, A. M. ; CHMIEL, J. S. ;
SYLVESTER, J. L. ; SENER, S. F. ; IMPERATO, J. P.:
Renal cell carcinoma: tumor size, stage and survival. Members of the
Cancer Incidence and End Results Committee.
In: J Urol
153 (1995), Nr. 3 Pt 2, S. 901–3
Han u.a. 2003 HAN, K. R. ; BUI, M. H. ;
PANTUCK, A. J. ; FREITAS, D. G. ; LEIBOVICH,
B. C. ; DOREY, F. J. ; ZISMAN, A. ; JANZEN,
N. K. ; MUKOUYAMA, H. ; FIGLIN, R. A. ;
BELLDEGRUN, A. S.:
TNM T3a renal cell carcinoma: adrenal gland involvement is not the
same as renal fat invasion.
In: J Urol
169 (2003), Nr. 3, S. 899–903; discussion 903–4
Hafez u.a. 1999 HAFEZ, K. S. ; FERGANY,
A. F. ; NOVICK, A. C.:
Nephron sparing surgery for localized renal cell carcinoma: impact of
tumor size on patient survival, tumor recurrence and TNM staging.
In: J Urol
162 (1999), Dec, Nr. 6, S. 1930–1933
A. K. Hemal, A. Kumar, R. Kumar, P. Wadhwa, A. Seth, und N. P. Gupta.
Laparoscopic versus open radical nephrectomy for large renal tumors:
a long-term prospective comparison.
J Urol, 177 (3): 862–866, Mar 2007.
Jocham u.a. 2004 JOCHAM, D. ; RICHTER, A. ;
HOFFMANN, L. ; IWIG, K. ; FAHLENKAMP, D. ;
ZAKRZEWSKI, G. ; SCHMITT, E. ; DANNENBERG, T. ;
LEHMACHER, W. ; WIETERSHEIM, J. von ; DOEHN, C.:
Adjuvant autologous renal tumor cell vaccine and risk of tumour
progression in patients with renal-cell carcinoma after radical nephrectomy:
phase III, randomised controlled trial.
In: Lancet
363 (2004), Nr. 9409, S. 594–9
B. Ljungberg et al., “EAU Guidelines: Renal Cell Carcinoma.” (2024). https://uroweb.org/guidelines/renal-cell-carcinoma/
Margulis, V.; Master, V. A.; Cost, N. G.; Leibovich, B.
C.; Joniau, S.; Kuczyk, M.; Mulders, P. F.; Kirkali, Z.; Wirth, M. P.;
Hirao, Y.; Rawal, S.; Chong, T. W. & Wood, C. G.
International
consultation on urologic diseases and the European association of urology
international consultation on locally advanced renal cell carcinoma.
Eur
Urol, 2011, 60, 673-683.
Minervini, A.; Serni, S.; Tuccio, A.; Siena, G.;
Vittori, G.; Masieri, L.; Giancane, S.; Lanciotti, M.; Khorrami, S.;
Lapini, A. & Carini, M.
Simple enucleation versus radical
nephrectomy in the treatment of pT1a and pT1b renal cell carcinoma.
Ann
Surg Oncol, 2012, 19, 694-700.
Patard, J.; Pignot, G.; Escudier, B.; Eisen, T.; Bex,
A.; Sternberg, C.; Rini, B.; Roigas, J.; Choueiri, T.; Bukowski, R.;
Motzer, R.; Kirkali, Z.; Mulders, P. & Bellmunt, J.
ICUD-EAU
International Consultation on Kidney Cancer 2010: treatment of metastatic
disease.
Eur Urol, 2011, 60, 684-690.
Poppel, H. V.; Becker, F.; Cadeddu, J. A.; Gill, I. S.;
Janetschek, G.; Jewett, M. A. S.; Laguna, M. P.; Marberger, M.; Montorsi,
F.; Polascik, T. J.; Ukimura, O. & Zhu, G.
Treatment of localised
renal cell carcinoma.
Eur Urol, 2011, 60, 662-672.
Poppel, H. V.; Pozzo, L. D.; Albrecht, W.; Matveev, V.;
Bono, A.; Borkowski, A.; Colombel, M.; Klotz, L.; Skinner, E.; Keane, T.;
Marreaud, S.; Collette, S. & Sylvester, R.
A prospective,
randomised EORTC intergroup phase 3 study comparing the oncologic outcome
of elective nephron-sparing surgery and radical nephrectomy for low-stage
renal cell carcinoma.
Eur Urol, 2011, 59, 543-552.
Robson u.a. 2002 ROBSON, C. J. ; CHURCHILL,
B. M. ; ANDERSON, W.:
The results of radical nephrectomy for renal cell carcinoma. 1969.
In: J Urol
167 (2002), Nr. 2 Pt 2, S. 873–5; discussion 876–7
Sun, M.; Trinh, Q.; Bianchi, M.; Hansen, J.; Hanna, N.;
Abdollah, F.; Shariat, S. F.; Briganti, A.; Montorsi, F.; Perrotte, P. &
Karakiewicz, P. I.
A non-cancer-related survival benefit is associated
with partial nephrectomy.
Eur Urol, 2012, 61,
725-731.
Tsui u.a. 2000 TSUI, K. H. ; SHVARTS, O. ;
SMITH, R. B. ; FIGLIN, R. A. ; DEKERNION, J. B. ;
BELLDEGRUN, A.:
Prognostic indicators for renal cell carcinoma: a multivariate
analysis of 643 patients using the revised 1997 TNM staging criteria.
In: J Urol
163 (2000), Nr. 4, S. 1090–5; quiz 1295
Weight, C. J.; Larson, B. T.; Fergany, A. F.; Gao, T.; Lane, B. R.; Campbell, S. C.; Kaouk, J. H.; Klein, E. A. & Novick, A. C.
Nephrectomy induced chronic renal insufficiency is associated with increased risk of
cardiovascular death and death from any cause in patients with localized
cT1b renal masses.
J Urol, 2010, 183, 1317-1323
Zini, L.; Perrotte, P.; Capitanio, U.; Jeldres, C.; Shariat, S. F.; Antebi, E.; Saad, F.; Patard, J.; Montorsi, F. &
Karakiewicz, P. I.
Radical versus partial nephrectomy: effect on
overall and noncancer mortality.
Cancer, 2009, 115,
1465-1471
 English Version: renal cell carcinoma: surgical therapy
English Version: renal cell carcinoma: surgical therapy
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.